1. 引言
近年来,研究者们通过分离鉴定发现了多种有抗Cr(VI)能力的细菌,如Serratia sp. S2 [1] 、Bacillus cereus [2] 、Bacillus licheniformis [3] 、Sporosarcina saromensis [4] 等。虽然大部分关于研究都集中在菌株的分离培养上,但目前针对其中的抗铬基因和蛋白进行的机制研究也在逐步开展。但这些研究缺乏全面性和系统性,本项目组思考是否能利用现代组学技术,以基因组学为基础,结合蛋白组学进行多组学联合分析,形成“DNA–蛋白质”关联网络,从而更全面了解细菌在外源Cr(VI)胁迫下的分子响应机制。
在前期研究中,本课题组从重庆市某中小电镀厂聚集地的Cr(VI)污染区域的淤泥中分离筛选得到对外源性高浓度Cr(VI)具有一定抗性的Serratia sp. CM01 [5] ,且采用iTRAQ蛋白定量技术研究了野生菌与高浓度Cr(VI)驯化菌中Cr(VI)抗性相关的差异蛋白 [6] ,发现CM01在应对Cr(VI)胁迫时表现出复杂的生物网络关联性,可能与能量代谢、氨基酸代谢、应激反应等多通路有关。研究者认为要全面系统进行细菌除Cr(VI)机制分析,不能缺乏基因水平的基础支撑。因此本研究利用前期的Serratia sp. CM01蛋白组和基因组分析结果 [7] ,筛选出其与Cr(VI)响应的相关基因,其中的trxA基因编码的是A型硫氧还蛋白(trxA),而全基因组测序结果显示Serratia sp. CM01中还存在有与之相似的C型硫氧还蛋白(trxC)。目前,硫氧还蛋白中被认为具有维持生物体内氧化还原平衡、调控生物信号传导、DNA及蛋白质损伤修复、抗逆环境等多种功能 [8] ,而高浓度Cr(VI)也可认为是逆环境的一种条件。为探究Serratia sp. CM01中硫氧还蛋白trxA和trxC的抗Cr(VI)功能,选取trxA、trxC基因进行克隆并构建工程菌,并通过工程菌的Cr(VI)抵抗特性实验进一步验证该基因表达后蛋白的Cr(VI)抵抗能力,为后续将微生物实际应用于治理环境中Cr(VI)污染提供新的思路。
2. 实验材料和方法
2.1. 实验材料
Serratia sp. CM01来源于本课题组前期在长期被高浓度Cr(VI)污染的环境中分离筛选出的一株能够耐受高浓度Cr(VI)的野生沙雷氏菌 [5] 。E. coli. DH5α、E. Coli. BL21 (DE3)、DNA marker预染蛋白Marker III (MP204)、DNA PCR产物纯化试剂盒、DNA琼脂糖凝胶回收试剂盒、质粒小提试剂盒、2 × pfu PCR Master Mix (高保真酶),购自天根生化科技(北京)有限公司。限制性核酸内切酶、T4 DNA连接酶来源于宝日医生物技术(北京)有限公司。引物合成和DNA测序由上海生工生物科技有限公司完成。SDS-PAGE蛋白凝胶试剂盒、BCA蛋白浓度测定试剂盒购自碧云天生物技术,抗His标签兔多克隆抗体、羊抗兔IgG-HRP购自北京博奥森生物技术有限公司,超敏ECL化学发光试剂盒购自美国millipore公司。pET-28a(+)中作为ChrA1和Srpc基因的表达载体,具有Kana抗性,购自Novagen公司,含有pET-28a(+)空质粒的E. coli. BL21 (DE3)作为对照菌,由本实验室自行制备。
2.2. 细菌培养
将Serratia sp. CM01从−80℃冰箱取出,接入LB培养基中,200 rpm,37℃,复苏12 h。用接种环取菌液在LB固体培养基上进行分区划线,37℃静置过夜培养。次日,挑取单菌落接入新的LB液体培养基中,200 rpm,37℃,过夜培养,得纯化菌液,用于DNA模板提取。
2.3. 硫氧还蛋白对应的基因引物设计和克隆
根据NCBI中Serratia sp. CM01的全基因组测序结果(PRJNA675313),已知的trxA、trxC基因序列,利用软件Primer Premier 5.0设计特异性PCR上下游引物,并在两端末端引入下游操作所需的特异性限制性核酸内切酶的酶切位点,碱基序列发送至上海生工合成引物,具体序列见表1。
注:1) 下划波浪线部分为保护碱基。2) 下滑直线部分为酶切位点。
2.4. 工程菌构建
将Serratia sp. CM01在LB培养基中培养至平台期,采用水煮沸模板法获得其基因组DNA [8] 。以提取的Serratia sp. CM01的DNA作为模板,以2 × Pfu Mastertmix (高保真酶)进行目的基因的扩增,其中设置trxA与trxC的退火温度分别为58.8℃与62℃,延伸时间均为30 s。所有扩增产物均采用1.5%琼脂糖凝胶电泳鉴定,随后用通用型DNA纯化回收试剂盒(离心柱型)进行纯化。
采用限制性内切酶对纯化的PCR产物和表达载体pET-28a(+)进行双酶切处理,采用通用型DNA纯化回收试剂盒将所得产物纯化。将目标DNA片段连接到pET-28a(+),生成重组质粒pET-28a(+)-trxA、pET-28a(+)-trxC。将重组质粒转移到大肠杆菌BL21 (DE3)中,构建trxA和trxC工程菌。以空载体pET-28a(+)为对照菌株,采用LB固体培养基(含50 ug/ml卡那霉素)和基因扩增技术(PCR)筛选含有目的基因的细菌,通过DNA测序验证工程菌中目的基因的碱基序列。
2.5. 工程菌目的蛋白的表达及鉴定
在含有50 μg/ml卡那霉素的LB液体培养基中分别接入两种种工程菌,培养至对数期(OD≈0.6),加入诱导剂IPTG,30℃培养6 h,同时诱导含空pET-28a(+)质粒的BL21(DE3)作为阴性对照。采用水煮法提取工程菌中蛋白,采用BCA蛋白浓度测定试剂盒(增强型)测定蛋白浓度。对提取的蛋白进行10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)和Western Blotting免疫印记实验,测定蛋白的大小和表达水平 [10] 。
2.6. 工程菌的抗铬能力及机制研究
2.6.1. 工程菌的生长曲线
在含有50 μg/ml卡那霉素的LB液体培养基中分别接入两种工程菌,37℃过夜培养。将菌液调制0.5麦氏浊度,按1:100的比例分别接入不含Cr(Ⅵ)和含5 mg/L Cr(Ⅵ)的LB液体培养基中,同时以含有pET-28a(+)空质粒的BL21(DE3)作为对照组,使用BIOSCREEN全自动生长曲线分析仪测定其24 h的生长曲线。
2.6.2. 工程菌的铬(Ⅵ)耐受能力
在LB液体培养基中分别接入两种工程菌、野生菌株CM01和对照株BL21 (DE3),37℃过夜培养。将4种菌液稀释至0.5麦氏浊度,按1:100分别接入含Cr2O72−(0, 5, 10, 15, 20 mg/L)的LB液体培养基中,37℃培养24 h,用紫外分光光度计测定OD600。
2.7. 统计学分析
所有实验组都设置3个平行对照。采用统计软件SPSS19.0进行统计分析,P < 0.05表示差异有统计学意义。
3. 结果与分析
3.1. 成功构建工程菌trxA和trxC
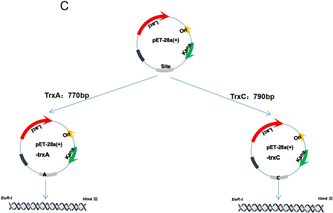
如图1所示,trxA、trxC工程菌中分别扩增出,trxA、trxC基因,其特异性引物对应的电泳条带大小与预期相符合(trxA基因:770 bp;trxC基因:790 bp)。T7/T7 TER通用引物对扩增出来片段由于含有pET-28a(+)的部分基因和T7启动子下游的多克隆位点及His编码序列等基因,因此条带大小理论上应大于特异性引物对扩增出的条带约230 bp,工程菌中trxA和trxC基因的通用引物对条带大小大概在1000 bp处,符合预期结果,说明trxA、trxC工程菌构建成功(图1A和图1B),重组质粒的建立过程如图1(C)所示。
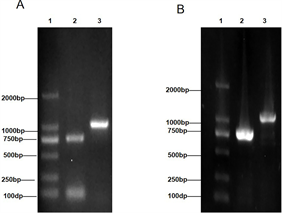
 注:1:DNA Marker(2000); 2:trxA/trxC条带–特异性引物对;3:trxA/trxC条带-T7通用引物对
注:1:DNA Marker(2000); 2:trxA/trxC条带–特异性引物对;3:trxA/trxC条带-T7通用引物对
Figure 1. PCR identification of pET-28a(+)-trxA/trxC engineering strains
图1. 重组表达质粒pET-28a(+)-trxA、trxC的PCR鉴定
3.2. 工程菌蛋白的表达及鉴定
两种工程菌中的蛋白表达情况如图2所示。由于工程菌蛋白进行表达时会融合一段pET-28a序列本身所编码的肽段,因此目的蛋白条带大小比预测值略大(预测值:trxA蛋白11.77 KDa,trxC蛋白14.15 KDa),trxA蛋白实际表达大小约为13 KDa (3泳道),trxC蛋白实际表达约为16 KDa (5泳道)。说明工程菌中trxA、trxC蛋白表达成功。
 注:1:trxA工程菌-Western Blotting;2:trxC工程菌-Western Blotting;3:trxA工程菌(诱导后)-SDS-PAGE;4:trxA工程菌(诱导前)-SDS-PAGE;5:trxC工程菌(诱导后)-SDS-PAGE;6:trxC工程菌(诱导前)-SDS-PAGE;7:Protein Marker
注:1:trxA工程菌-Western Blotting;2:trxC工程菌-Western Blotting;3:trxA工程菌(诱导后)-SDS-PAGE;4:trxA工程菌(诱导前)-SDS-PAGE;5:trxC工程菌(诱导后)-SDS-PAGE;6:trxC工程菌(诱导前)-SDS-PAGE;7:Protein Marker
Figure 2. SDS-PAGE and Western blotting analysis of trxA/trxC protein in two engineered strains
图2. 两种工程菌中trxA/trxC蛋白的SDS-PAGE电泳图及Western blotting分析
3.3. 工程菌的生长曲线
采用全自动生长曲线分析仪测定两种工程菌、Serratia sp. CM01和Control strain (BL21(DE3))的生长曲线(图3),发现Cr(VI)对菌株生长有显著胁迫作用。在没有Cr(VI)胁迫下(图3A),两种菌的生长曲线与对照组BL21 (DE3)的生长曲线没有明显差异(P > 0.05)。在Cr(VI)胁迫的条件下(图3B),工程菌与对照组BL21 (DE3)表现出不同的生长趋势,并且trxA和trxC到达稳定期时间基本相同,稳定期菌量为CM01 > trxA ≈ trxC > BL21 (DE3) (P < 0.05),说明工程菌内存在的trxA、trxC蛋白可帮助其适应Cr(VI)胁迫环境。
3.4. 工程菌铬耐受能力
根据两种工程菌、Serratia sp. CM01和对照株BL21 (DE3)菌株在不同浓度Cr(VI)的LB培养基中存活24 h后的A600值,可以看出各菌株对Cr(VI)的耐受能力有所不同。结果如图4所示,各菌对Cr(VI)的耐受能力依次为:Serratia sp. CM01 > trxA > trxC > BL21 (DE3) (P < 0.05)。即工程菌ChrA、trxC对Cr(VI)的抗性强于对照菌株BL21 (DE3)。在5 mg/L和10 mg/L Cr(VI)浓度下,对照菌株BL21 (DE3)几乎无法生
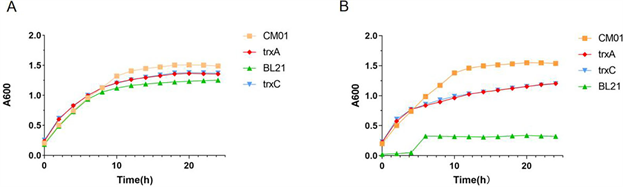 注:(A) 两种工程菌在没有Cr(Ⅵ)胁迫下的生长曲线。(B) 两种工程菌在Cr(Ⅵ)胁迫下的生长曲线。
注:(A) 两种工程菌在没有Cr(Ⅵ)胁迫下的生长曲线。(B) 两种工程菌在Cr(Ⅵ)胁迫下的生长曲线。
Figure 3. Growth curves of two engineered bacteria
图3. 两种工程菌的生长曲线
长,不具备在含Cr(VI)环境中生存的能力,而通过基因重组构建得到的trxA、trxC工程菌生长情况较好,表明trxA、trxC蛋白赋予工程菌一定程度的耐Cr(VI)能力,且trxA蛋白赋予工程菌的抗Cr(VI)能力强于trxC蛋白。

Figure 4. Chromium tolerance of strains under different Cr(Ⅵ) concentration
图4. 不同Cr(Ⅵ)浓度下各菌株的铬耐受能力
4. 讨论
微生物法具有经济效益高、环保等优点,被认为是修复Cr(VI)环境污染的主流方法之一 [11] 。但由于野生型菌株存在的Cr(VI)还原效率低,对Cr(VI)耐受能力差,以及会对人体健康造成危害等问题,阻碍了其在实际生活中的应用。本文基于对以前从铬(VI)污染的环境中分离出的耐铬Serratia sp. CM01菌株进行的蛋白组和全基因组分析结果 [7] ,筛选出了抗Cr(VI)相关基因trxA、trxC。该基因对应的硫氧还蛋白是一类广泛存在于原核和真核生物体内的蛋白质 [8] 。迄今,已有对多个物种的硫氧还蛋白结构进行了解析和功能的初步研究。通过比对发现,在不同的物种中发现的硫氧还蛋白在进化上高度保守,其分子量约为12 kDa左右,为小分子蛋白质且具有-Cys-Gly-Pro-Cys-(-CGPC-)的功能活性中心位点 [12] 。目前,已有的研究发现的硫氧还蛋白的类型主要可以分为A型硫氧还蛋白(trxA)、C型硫氧还蛋白(trxC)、F型硫氧还蛋白(trxF)、H型硫氧还蛋白(trxH)等多个类型 [13] - [18] 。其分型的主要依据是氨基酸的序列及蛋白结构的不同。不同类型硫氧还蛋白具有不同的生物功能,在生物中的分布也不同。由硫氧还蛋白(Thioredoxin, trx)、硫氧还蛋白还原酶(Thioredoxin reductase, trxR)、还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)构成的硫氧还蛋白系统在生物体中能催化一系列生理生化反应和功能维持,参与众多生理过程,发挥着重要的生物学功能 [19] ,但与其相关的调控机制尚未明确,仍待更深入的探索。
本研究选取了Serratia sp. CM01中的硫氧还蛋白trxA、trxC为研究对象,利用基因工程技术,构建了两种基因工程菌,并通过相关蛋白的异源表达使菌株具有抗铬能力,但工程菌的铬耐受能力弱于Serratia sp. CM01,表明Serratia sp. CM01的抗Cr(VI)过程不仅依赖于硫氧还蛋白系统,还依赖于全基因组中与铬代谢相关的其他基因共同作用。与野生菌株相比,工程菌的Cr(VI)抗性没有那么强,但解决了野生型菌株不可控性和可能存在的人体危害作用,因此不可否认工程菌具有处理Cr(VI)污染的潜力,可通过进一步研究应用于实际环境中进行铬污染治理。
致谢
本项目所使用的大型仪器设备均由重庆医科大学公共卫生学院提供。
基金项目
本研究由国家自然科学基金(项目编号:cstc2020jcyj-msxmX0540)和重庆医科大学学生科研创新项目(项目编号:SIEP202142)提供资助。
参考文献