1. 引言
尿酸(uric acid,UA)在人体中主要以晶体盐形式存在 [1]。随着人民生活水平不断提高,海鲜、啤酒一类高嘌呤食物的摄入量在不断增加 [2]。人体尿酸水平的不断升高,使高尿酸成为继高血压,高血脂,高血糖“三高”之后的“第四高” [3]。高尿酸会导致痛风、动脉粥样硬化、高血压、高脂血症等疾病,随着这些疾病患病率逐渐升高,降尿酸药物的研发显得更加迫切。
目前临床上降尿酸的主要治疗方向分别为急性痛风消炎药以及间歇性和慢性痛风的治疗两方面 [4]。前者具有快速缓解患者病症,控制痛风急性发作的作用,但普遍不具备降低患者血尿酸水平的功效,仅在痛风发作时作为紧急用药,且大多数药物具有很大副作用 [5]。后者不仅可以降低患者血尿酸水平,且副作用小,可作为治疗痛风的主要药物长期服用。研发间歇性和慢性痛风治疗的药物分为四个主要方向:减少尿酸盐生成;增加尿酸盐排泄;防止尿酸盐形成;分解尿酸盐 [6]。尿酸氧化酶是研究增加尿酸盐排泄和分解尿酸盐的重要方向,尿酸氧化酶可将尿酸氧化分解为溶解度比尿酸大5~10倍的尿囊素进而排出体外 [7],因此尿酸氧化酶在增加尿酸排泄和分解尿酸盐方面效果显著。
自然界绝大多数生物体内均存在尿酸氧化酶,但人体及猿类在长期进化过程中丢失了自主合成尿酸氧化酶的基因 [8]。因此引入外源尿酸氧化酶基因成为降低人体高尿酸的一个重要途径 [9] [10]。在20世纪50年代就有外源性尿酸氧化酶作为生物生物制剂用于临床 [11],而且尿酸氧化酶也是检测尿酸水平的常用方法 [12]。国外关于尿酸氧化酶的研究可追溯至1905年 [13],国内直至1994年于青琳 [14] [15] 等人在芽孢杆菌种成功表达出尿酸氧化酶基因,才出现尿酸氧化酶的相关报道。尿酸氧化酶作为十分重要的医药用酶,在临床诊断和高尿酸相关疾病的治疗上具有非常广泛的应用前景,因此近年来学术界对尿酸氧化酶相关研究的重视程度不断增加 [16]。但目前所研发的尿酸酶类药物仍具有酶产量低、分离纯化程序复杂、酶学性质不稳定、抗原性高的问题 [17]。同时大多有不同程度的毒副作用,如引起肠胃不适、过敏、肾衰竭等不良反应 [18]。因此现当下对于尿酸氧化酶的研究任重道远。
本研究对青海省茶卡盐湖地区的嗜碱细菌进行分离,茶卡盐湖的高盐性改变了周边土壤微生物的生存环境 [19],特殊的环境为筛选优良降尿酸菌株提供了一个重要的来源。以尿酸作为唯一碳源筛选产尿酸氧化酶菌株,在丰富我国尿酸降解菌微生物物种资源库和基因库的同时也为嗜碱菌资源的开发利用和逆抗基因的发掘奠定了科学基础,本研究对该嗜碱菌所产尿酸氧化酶的酶学性质做了初步探究,有望为开发利用尿酸氧化酶类药物提供理论依据和菌种资源。
2. 材料与方法
2.1. 实验材料
2.1.1. 土样及其来源
实验样品来自青海省茶卡盐湖(介于东经99˚02′北纬36˚18′~45′之间)泥沙。
2.1.2. 培养基及试剂
尿酸基础培养基(g/L):MgSO4∙7H2O 0.5,NaCl 30,K2HPO4∙3H2O 0.5,pH 7.5,KH2PO4 0.5,酵母提取物1,加3%琼脂的固体培养基,尿酸2。
产尿酸氧化酶筛选培养基(g/L):pH 7.5,蛋白胨5,尿酸3,氯化钠2,牛肉膏提取物3,琼脂30。
产尿酸氧化酶发酵培养基(g/L):尿酸1.5,KH2PO4 1,NaCl 30,蔗糖20,MgSO4∙7H2O 1,酵母提取物1,蛋白胨10,FeSO4 0.01,pH 7.5。
试剂:柠檬酸钠缓冲液(pH 4.0~8.0),Gly-NaOH 缓冲液(pH 8.0~10.0),PBS缓冲液(pH 7.6),0.6 mmol/L 硼酸–尿酸储备液(pH 8.5)所配试剂均为国产分析纯。
2.2. 方法
2.2.1. 产尿酸氧化酶菌株的筛选
将1 g土样加入100 ml以尿酸为唯一碳源的尿酸培养基中,25℃下震荡富集培养6~7 h后取出,将富集液稀释10−1、10−2、10−3、10−4、10−5倍,每个梯度取200 μL涂布到以尿酸作为唯一碳源的平板中继续培养,直至长出菌体,反复纯化。纯化后接种至产尿酸氧化酶筛选培养基,通过比较透明圈大小初步判断菌株产酶活性,挑选潜力菌株用于后续实验。
2.2.2. 菌株生长、尿酸降解量及胞内外粗酶活检测
将菌株接种到发酵培养基中25℃,180 r/min震荡培养,每间隔12 h进行取样。OD600表示菌体量,OD290表示尿酸降解量。对胞内外粗酶的酶活性检测,测定反应前后吸光值。1 µmol尿酸在1 min时降解用的酶量为酶活力单位,具体公式如下:
2.2.3. 产酶菌株16S rRNA基因测序及鉴定
根据DNA提取试剂盒提取2YHBJ-3的细菌基因组,使用通用引物 (27F:5’-AGAGTTTGATCCTGGCTCAG-3’和1492R:5’-GGTTACCTTGTTACGACTT-3’)以此扩增细菌的16S rRNA。PCR扩增条件为:预变性在94℃条件下持续4 min;变性30 s,在94℃条件下;退火温度为55℃,持续35 s;延伸90 s,在72℃条件下进行;进行32个循环;最后在72℃条件下再进行延伸,时间为10 min。产物进行琼脂糖凝胶电泳实验,将条带正确的PCR扩增产物送至测序,测序结果上传GenBank (http://www.ncbi.nlm.nih.gov/genbank),根据获得的序列与BLAST数据库中细菌16S rRNA基因序列进行比较,利用软件MEGA 7.1进行系统进化分析。
2.2.4. 酶学性质
将最适发酵培养时段的发酵液收集后进行离心,收集菌体至50 ml离心管,向其中加入30 ml pH为 7.6的PBS缓冲液,冰浴下超声破碎30 min后离心,保留上清液即胞内粗酶,用于后续实验。
1) 温度对尿酸氧化酶活性的影响
将酶液分别在0℃~60℃条件下(每5℃为一个梯度)与尿酸反应30 min,阴性纯水调零,利用紫外分光光度计测定反应后的吸光值(重复三次,下同),通过阳性与实验差值计算出尿酸氧化酶相对活性并绘图。
2) pH对尿酸氧化酶活性的影响
在最适反应温度下,检测不同的pH (pH为3.0、3.6、4.0、4.6、5.0、5.6、7.0、7.6、8.0、8.6、9.0、9.6、10.0)条件下尿酸氧化酶的活性,一组实验由三个平行组成。
3) 温度对尿酸氧化酶稳定性的影响
在最适pH缓冲液中加入定量酶液,分别在15℃、20℃、25℃下处理20~180 min后测定酶活,每间隔20 min为一个梯度,保温0 min的作为对照组,与另外三个温度下测得数据比较。一组实验由三个平行组成。
4) pH对尿酸氧化酶稳定性的影响
在4℃环境下将酶液至于不同的pH缓冲液(pH 3.0~10.0)中分别处理12 h和24 h。(每0.6个pH为一个梯度)测定酶活性,对照组不做处理,一组实验由三个平行组成。
5) 金属离子及抑制剂耐受性
将不同的金属离子和不同抑制剂加入到反应体系中。以无添加的反应混合物作为对照(100%)。每组实验设置3个平行。
3. 结果
3.1. 产尿酸酶菌株的筛选与鉴定
从青海茶卡盐湖的土样中分离得到产尿酸酶菌株,通过透明圈及菌落直径比初步判断其产酶活性,挑选出比值最大菌株,编号2YHBJ-3,菌株及透明圈如图1所示。经初步酶活测试,酶活力为0.0085 U/mL。经PCR凝胶电泳实验,初步判断其大小为1500 bp,经16S rRNA测序,与数据库中的序列进行同源性比对得,菌株2YHBJ-3的尿酸氧化酶基因序列长度为1459 bp,与理论结果相符。与Bacillus simplex KJ524507相似性为100%,系统进化树见图2,从图中可以看出2YHBJ-3与Bacillus simplex聚于一支,表明2YHBJ-3应属于芽孢杆菌(Bacillus)属。
Figure 1. Pure bacterial diagram (A) and transparent circle plate (B)
图1. 纯菌图(A)及透明圈平板(B)

Figure 2. Phylogenetic tree of strain 2YHBJ-3 was constructed based on the homology of 16S rRNA sequence
图2. 基于16S rRNA基因序列同源性构建菌株2YHBJ-3的系统进化树
3.2. 菌株生长及尿酸降解量曲线图
实验结果图3显示,菌株2YHBJ-3经发酵培养,菌株生长在0 h到12 h时生长较为缓慢,但尿酸分解速度较快。12 h到24 h生长迅速,生物量迅速增加。24 h后菌体生长开始放缓,直到48 h后生物量增加趋于平缓,在48 h后显示尿酸残余量(OD290)趋于平稳。在尿酸分解的两个较多的时期(0~12 h, 36~48 h)菌体量都有明显增长。
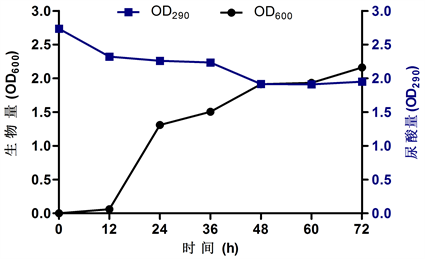
Figure 3. Growth and uric acid degradation curves of 2YHBJ-3 strain
图3. 菌株2YHBJ-3生长量及尿酸降解量曲线
3.3. 胞内外粗酶酶活测定
根据实验方法检测各时间段胞内及胞外酶的活性,得到48 h胞内酶活性最高(图4),选择该时间段的胞内酶做为实验用酶开展后续实验。
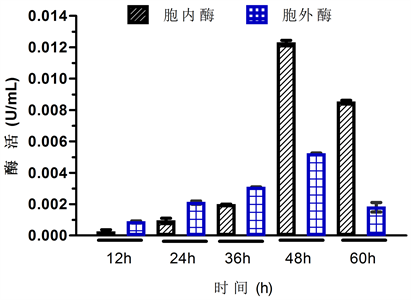
Figure 4. Extracellular and intracellular crude enzyme activity of 2YHBJ-3
图4. 菌株2YHBJ-3的胞内及胞外粗酶酶活性
3.4. 尿酸酶的酶学性质鉴定
3.4.1. 最适反应温度及最适反应pH测定
根据实验方法,将酶液置于不同的温度下反应,测出酶的最适反应温度,绘图;将酶液置于不同pH条件下,测出酶的最适反应pH,绘图。如图5所示。
 (A)
(A)  (B)
(B)
Figure 5. Effects of temperature (A) and pH (B) on the activity of strain 2YHBJ-3
图5. 温度(A)和pH (B)对菌株2YHBJ-3酶活性影响
如图5所示,温度在从0℃上升至20℃的过程中,尿酸酶的相对酶活性从0%上升至100%,处于上升趋势,在20℃~50℃酶相对活性逐步下降,50℃后相对酶活性急剧下降,直至失活,结果表明该尿酸氧化酶的最适反应温度为20℃。在pH为3.0至6.6范围内,该酶活性上升至100%,当pH超过6.6后,相对酶活下降。实验结果表明最适pH为6.6。
3.4.2. pH耐受及温度耐受的测定
不做处理的酶为对照组,不同pH下孵育12 h和24 h后测酶活,得到pH-相对酶活性曲线。不同温度下保温并处理20~180 min,每20 min测一次活性,得到温度–相对酶活性曲线(图6)。
 (A)
(A)  (B)
(B)
Figure 6. Effects of temperature (A) and pH (B) on the stability of strain 2YHBJ-3
图6. 温度(A)及pH (B)对菌株2YHBJ-3粗酶稳定性的影响
结果显示,如图6(A),各pH下孵育12 h的酶活均高于24 h。如图6(B),各温度下孵育100 min时仍具有60%以上的相对活性,两组实验表明该酶对环境具有一定的适应性。
3.4.3. 金属离子及抑制剂对酶活性影响的鉴定
 (A)
(A) 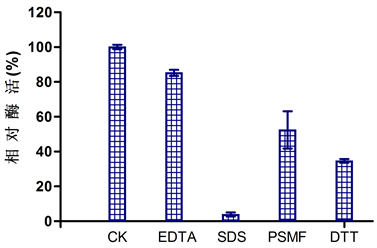 (B)
(B)
Figure 7. Effects of metal ions (A) and inhibitors (B) on the stability of strain 2YHBJ-3
图7. 金属离子(A)及抑制剂(B)对菌株2YHBJ-3粗酶活性的影响
如图7所示,K+、Co2+、Pb2+、Zn2+、Al3+等离子对酶活影响较小,Cu2+对酶有抑制作用,Mg2+、Fe2+、Fe3+、Ca2+、Ni2+、Ba2+、Mn2+等表现出显著激活作用,其中Mg2+对酶促进效果最好。在抑制剂中所有抑制剂都表现出了抑制效果,其中SDS的效果最好。
4. 讨论
尿酸氧化酶广泛存在各种生物体内,植物、真菌、酵母、细菌以及一些哺乳动物中都有尿酸氧化酶存在 [20]。近年来,微生物来源的尿酸氧化酶逐渐成为研究热点,微生物凭借自身种类多,繁殖快,代谢途径多样等特点,成为尿酸氧化酶的重要来源。尿酸氧化酶在治疗高尿酸血症方面具有巨大的潜力,寻找更多不同来源的尿酸氧化酶对于高效尿酸酶类药物的研究具有一定的意义 [1]。本研究从茶卡盐湖土样中分离得到一株尿酸降解菌2YHBJ-3,经发酵培养及初步酶活检测,测得该菌株尿酸酶活力为0.0085 U/mL,与潘冬雷等报道菌株比较,酶活力相对较低。经16S r RNA基因序列比对,2YHBJ-3为Bacillus属菌株。实验中测得该酶的最适温度为20℃,最适pH为6.6,与近年从海洋环境中筛选得到的产尿酸酶菌株及 [21] [22] 报道菌株比较,该酶的最适温度较低,属于中温酶,在25℃下保存最为稳定。最适pH为6.6,低于目前郭源 [23],王颖 [24],武文明 [25] 所研究的尿酸氧化酶最适pH为8左右。大多数尿酸氧化酶在碱性环境下较为稳定,2YHBJ-3虽来源于盐碱环境,但属于中性酶。在温度耐受性的实验中,温度越高,时间越长,酶活性越低,符合酶的一般性质。本研究中,酶的最适温度较人体温度低,但在37℃反应下,仍保持60%以上活性,可为后续的医药开发提供酶学基础;在pH为3.0~10.0的环境中分别孵育12 h、24 h,各pH下孵育12 h的酶活均高于24 h。最适pH下24 h仍保留60%以上活性。两组数据说明该酶具有一定的环境适应性;在金属离子及抑制剂耐受方面,Mg2+的促进作用最为明显,这与林铿淳等人 [18] 所报道菌株具有一定相似性,对该酶抑制作用最明显的离子及抑制剂为Cu2+和SDS。Cu2+对大多数尿酸酶均具有抑制作用,与咸静女 [22] 等人所研究同样是芽孢杆菌来源Uox的结果一致。本研究对该菌株所产尿酸氧化酶进行初步研究,对该酶的后续研究具有一定意义,同时为挖掘盐环境尿酸降解菌资源提供了参考。
NOTES
*通讯作者。