1. 引言
药品是指为预防、治疗、诊断人体疾病,有目的地调节人体生理功能,规定适应症或者功能适应症、用法用量的一类特殊物质。在原料药的生产和储存过程中,影响药品纯度的物质称为杂质 [1],药品中的杂质会影响药物的稳定性及疗效,甚至导致不良反应事件的发生 [2]。在杂质研究领域中,基因毒性杂质备受关注。Ashby [3] 等首次提出了基因毒性的概念,并将基因毒性杂质(genotoxic impurity, GTI)定义为“经过适当遗传毒性实验模型,如细菌基因突变(Ames)实验,证实具有遗传毒性的杂质”。其可能导致DNA损伤或突变,从而直接影响DNA的功能或改变其遗传特性,引起致癌、致突变、致畸变等遗传毒性 [4]。
基因毒性杂质的来源贯穿于药品的整个生产和流通。药物中基因毒性杂质的来源包括原料药合成的起始物料、反应中间体、催化剂和试剂等。同时,如果在药物的制剂、储存或运输过程中处理不当 [5],也会产生相应的基因毒性杂质。基因毒性杂质与普通的杂质前期发展相似,在20世纪80年代末~90年代初开始被系统地研究。由于药物分析行业的不断发展,灵敏度更高的仪器(如HPLC-MS、GC-MS)等大规模应用于药物分析和检测,基因毒性杂质逐渐被检出 [6]。
近年来,关于药物中基因毒性杂质超标导致药品召回的不良事件均有报道。2020年9月,美国FDA数据库显示,超过1400个产品批次已从市场召回,原因是致癌性的基因毒性杂质N-亚硝胺含量超过了可接受的摄入量26.5 ng/天,召回药物包括缬沙坦、厄贝沙坦、二甲双胍、雷尼替丁等 [7]。同时,因为痕量基因毒性杂质的残留而引发的医疗事故也频繁发生,如备受关注的甲磺酸奈非那韦事件以及近两年出现的N-亚硝基二甲胺事件。这引起各国药品监督管理部门的高度重视,针对此类事件,对基因毒性杂质的控制出台了一系列的指导性文件。目的是为了严控控制基因毒性杂质在药物中的限度,保证患者用药安全。
人用药品技术要求国际协调理事会(The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use, ICH)、欧洲药品管理局(European Medicines Agency, EMA)及美国食品药品监督管理局(Food and Drug Administration, FDA)都陆续提出了基因毒性杂质研究策略和限度要求 [8] [9] [10],我国国家药品监督管理局药品审评中心(CDE)也于2020年5月8日发布了《化学药物中亚硝胺类杂质研究技术指导原则(试行)》 [11],查阅各类法规可知,目前普遍采用“警示结构”的方法,将可能引起基因毒性的结构列入关注队列,含有这些基团的杂质通常被认为具有潜在基因毒性。
高效液相色谱–质谱联用技术(High Performance Liquid Chromatography-Mass Spectrometry, HPLC-MS),即HPLC-MS联用技术。具有高选择性以及高灵敏度,在药物分析的鉴别、定量中可以显著提高方法的灵敏度,能最大限度减少干扰,满足基因毒性杂质痕量分析的要求,是近年基因毒性杂质检测常用的技术。它既可以有效整合多样化的结构信息,又能高效分离出待测物,特别适用其分离和结构识别。在当前的医学领域中,HPLC-MS联用技术之已成为研究杂质最有力的分析工具之一。
本文将从基因毒性杂质的分类、限度要求、各类基因毒性杂质在HPLC-MS中的应用及目前研究所面临的问题4个方面进行阐述,为基因毒性杂质的进一步研究提供参考。
2. 基因毒性杂质的分类
目前主要通过毒理学评估手段(体外Ames实验为主)辅以体内实验评估化合物是否具有基因毒性。经过化学结构研究及毒理学评价,发现某些官能团或亚结构单元,能与生物体内的一些功能性的大分子发生作用,从而引起基因突变。由于其对生物活性具有一定的警示作用,又称警示结构 [12]。利用警示结构判断化合物是否具有基因毒性,使对基因毒性杂质的判断更加迅速,开展研究也更具针对性。Ashby等 [13] 假设了一个超级化合物,将很多警示结构包含在其中(图1)。结合文献及相关研究,将其中较为普遍的警示结构解析出来。见表1。
EMA和FDA指南都认为利用警示结构去研究基因毒性杂质是有效方法之一。但需注意的是,具有警示结构的化合物不一定具有基因毒性,只是其含基因毒性的可能性比较高,需对其做进一步的毒理学评估。例如,吡啶类的氮氧化合物,近期有研究表明其引起基因毒性的可能性很小 [14],但由于其被列入警示结构,申报人在提交新药申请时,涉及到此类化合物都被要求评估其产生基因毒性的风险,大大增加了不必要的研究成本。

Table 1. Common warning functional groups
表1. 常见的警示性官能团
A:烷基、芳香基或氢原子;Halogen:F,Cl,Br,I;EWG:吸电子基团,如氰基和羰基等。
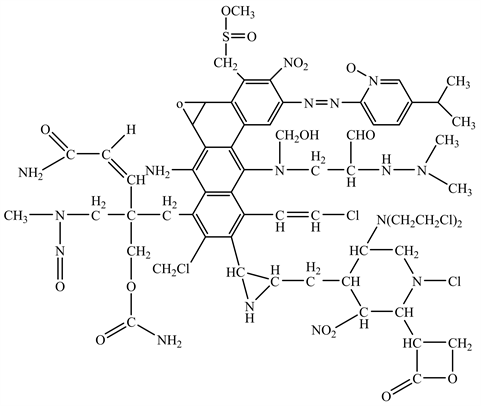
Figure 1. Structure of super compounds
图1. 超级化合物的结构
3. 基因毒性杂质的限度要求
限度要求
针对基因毒性杂质的限度,2006年欧洲EMA和2008年美国FDA在指南中都提出用“毒理学关注阈值”(Threshold of toxicological concern, TTC)作为基因毒性杂质的可接受限度 [15]。TTC具体含义为在人的一生(70岁)中,每天摄入1.5 μg基因毒性杂质,其致癌的风险是可接受的(<1/100000)。故在实际检测中,基因毒性杂质常常采用限度检查的方法。阶段性基因毒性杂质的限制摄入量见表2。
但需注意的是,TTC不能被认为是绝对安全的保障,在药物上市过程中,还是需要更加具体的毒性数据以及更灵敏的检测技术来确定基因毒性杂质的允许摄入量。2019年1月23日,国家药典委员会根据我国国情发布了《关于
<中国药典>
2020年版四部通则增修订内容的公示》,新增了内容“遗传毒性杂质控制指导原则审核稿”,其对药物基因毒性杂质的分类和控制做了进一步的指导 [16],本指导原则包括了危害评估方法、可接受摄入量计算方法和限值制定方法。表明我国在原料药以及药物制剂中基因毒性杂质的限度控制上应该更加严格规范。

Table 2. Acceptable limits for genotoxic impurities specified by EMA and FDA in stages
表2. 阶段性EMA和FDA规定的基因毒性杂质可接受的限度
4. 不同类型的基因毒性杂质的研究
药物中的基因毒性杂质必须控制在低于0.01%~0.03%的限度内 [17] [18]。这就需要使用高灵敏度的分析仪器,同时还要求检测方法具有更高的选择性。HPLC-MS作为杂质分析最有力的工具之一,近年来已广泛应用于基因毒性杂质的检测。下面是常见的一些基因毒性杂质的检测实例:
4.1. 亚硝胺类化合物
亚硝胺类基因毒性杂质是公认的强致癌物之一,应保持较高的警惕性和敏感性。常见的亚硝胺类结构如图2。
 N-亚硝基吡啶烷N-二甲基亚硝胺 N-二乙基亚硝胺N-二丙基亚硝胺
N-亚硝基吡啶烷N-二甲基亚硝胺 N-二乙基亚硝胺N-二丙基亚硝胺
Figure 2. Structures of GTIs in nitroamine
图2. 常见亚硝胺类基因毒性杂质结构
Khorolskiy M等 [19] 建立了一种HPLC-MS/MS方法能同时测定缬沙坦、氯沙坦和厄贝沙坦中亚硝胺类的基因毒性杂质,并优化了质谱条件使其摆脱基质效应成为可能,袁松等 [20] 运用HPLC-MS/MS测定了奥美沙坦酯中7种类型的基因毒性杂质。在工艺合成路线中,如同时使用胺类化合物与亚硝酸盐,也应研究可能产生的相关亚硝胺类杂质。例如,在替格瑞洛工艺合成路线 [21] (图3)的步骤2中,重氮化环化反应在亚硝酸钠/乙酸条件下进行,理论上可能与中间体M1中含有的仲胺等第二类胺类化合物发生反应,或者是与胺类试剂如三乙醇胺(TEA)、三乙胺等引入的第二类试剂的结构发生相互作用,可能存在产生亚硝胺类杂质的风险。应注意防范。
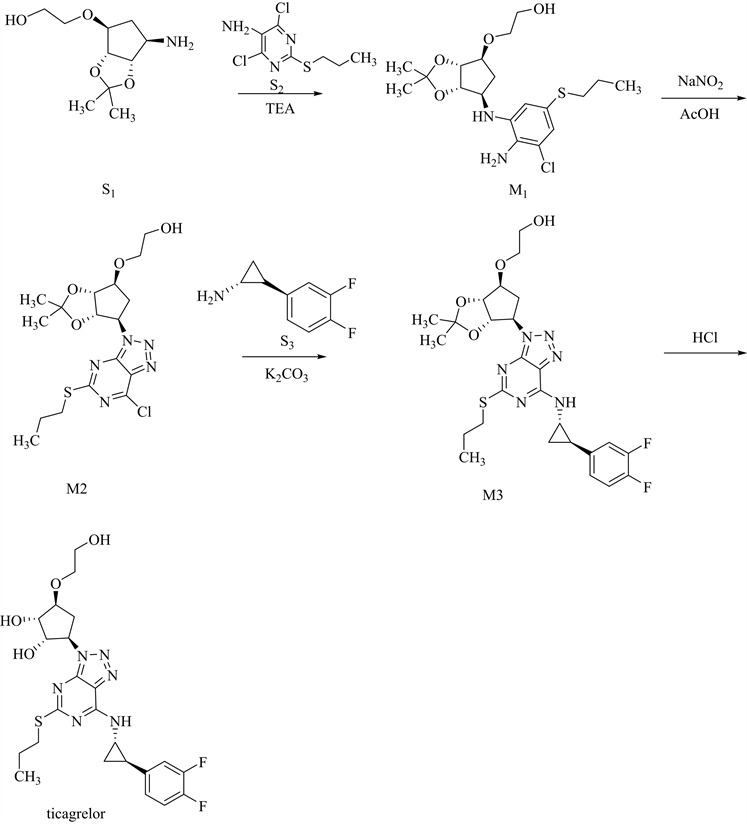
Figure 3. Synthetic route of ticagrelor
图3. 替格瑞洛的合成路线
4.2. 磺酸酯类化合物
骆美玉等 [22] 建立了不需要前处理的HPLC-MS/MS方法对盐酸吉西他滨中甲磺酸甲酯(methyl methanesulfonate, MMS)、甲磺酸甲酯(ethyl methanesulfonate, EMS)进行了测定。其灵敏度高,重现性好。曹琳等 [23] 采用LC-QQQ-MS/MS分析苯磺酸氨氯地平中痕量苯磺酸酯类基因毒性杂质,其建立的方法准确度良好,使用于芳香基磺酸酯类基因毒性杂质的测定。为了优化分析结果、避免衍生化过程中醇类和卤代烃的引入造成假阳性,易大为等 [24] 采用乙腈–水为专有溶剂,建立衍生化气相色谱–质谱联用(GC-MS)技术分别对甲磺酸培氟沙星中的MMS、EMS、甲磺酸异丙酯(isopropyl methanesulfonate, IMS)和甲磺酸萘莫司他原料药中的MMS、EMS进行了检测。常见的甲磺酸类基因毒性杂质见图4。
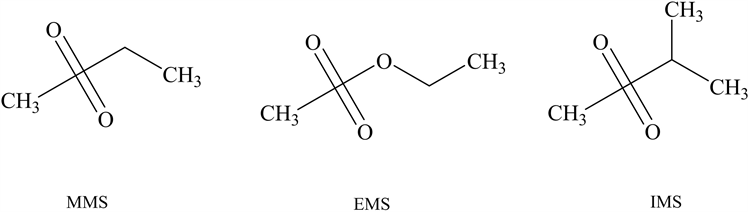
Figure 4. Structure of common methanesulfonic acid genotoxic impurities
图4. 常见甲磺酸类基因毒性杂质结构
4.3. 肼类化合物
肼类化合物是目前已知具有较强的亲核性和潜在致癌性的基因毒性杂质(见图5)。其性质活泼,很容易和色谱柱上的硅氧基发生反应,导致峰形拖尾。建立一种简便,快捷,灵敏度高的分析方法对肼类基因毒性杂质进行测定是必不可少的。冯蕊等 [25] 建立LC-MS法去测定塞来昔布中对肼基苯磺酰胺[(4-sulfamoylphenyl) hydrazine, SHH]和对甲苯腙基苯磺酰胺[(4-methyl-acetophe-none) para-sulfonamide phenylhydrazine, MAP]2个苯肼类基因毒性杂质。肼类化合物极性较大,需要衍生化前处理增加挥发性和稳定性,Lakshmp KJ等 [26] 建立了离子交换色谱法–电导检测器对西拉普利中残留的肼类物质进行了测定。该方法样品前处理简单、高效且具有很高的灵敏度。肼类化合物作为潜在的基因毒性杂质,大多是从起始物料或者中间体中直接带入或者从合成副反应中引入,因此在生产过程中要对其进行相应的控制,建立合适的质量标准和已验证的分析方法对其进行痕量残留检测。
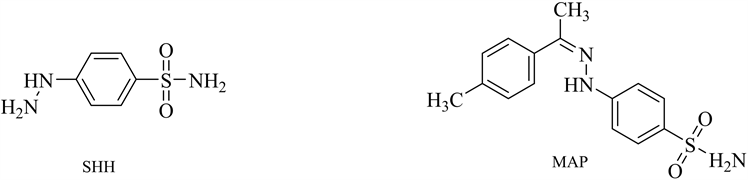
Figure 5. The structure of common hydrazine compounds genotoxic impurities
图5. 常见肼类化合物基因毒性杂质结构
4.4. 其他类型的基因毒性杂质
Iliou K等 [27] 提出了一种LC-MS/MS方法用于定量测定雷贝拉唑中两种潜在的基因毒性杂质,通过优化流动相中缓冲盐的pH值和浓度,并按照ICH指南进行方法学验证其建立的方法专属性良好,灵敏度高。Al-Sabti B等 [28] 利用HPLC-MS测定维格列汀中吡啶、4-二甲氨基吡啶的含量,吡啶类化合物是用于维格列汀药物中的活性碱,其含有亲电官能团,被认为是潜在的基因毒性杂质。李锐等 [29] 建立了高效液相色谱–四极杆/线性离子阱质谱法(HPLC-QTRAP-MS/MS)同时测定艾司奥美拉唑钠中氮氧物(GTIE)和氮氧磺酰物(GTII) 2种潜在基因毒性杂质。艾司奥美拉唑钠是一种质子泵抑制剂,应用于胃食管返流病、消化性溃疡等酸相关性疾病的治疗。在其合成过程中用到了过氧化物体系,在氧化反应时可能生成副产物奥美拉唑氮氧物(OmeprazoleN-oxide, GTIE)及奥美拉唑氮氧磺酰物(OmeprazolesulfonylateN-oxide, GTII),属于潜在的基因毒性杂质,需在制剂生产中加以控制。常见的氮杂芳基N-氧化物基因毒性杂质见图6。
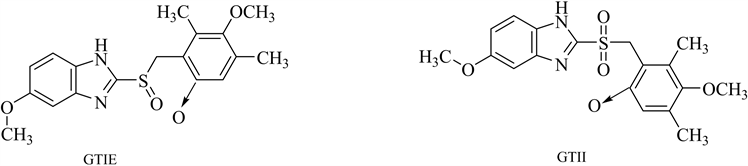
Figure 6. Structure of common azaaryl N-oxide genotoxic impurities
图6. 常见氮杂芳基N-氧化物基因毒性杂质结构
5. 目前基因毒性杂质研究所面临的问题
5.1. 基因毒性杂质的限度低
基因毒性杂质检测时,由于其限度较低,要达到所需要的检测限,就必须要配制高浓度的供试品溶液。然而,高浓度的供试品溶液可能会面临堵塞色谱柱、污染离子源、以及基质效应等问题,检测难度大大增加 [30]。同时其检测一般使用气质联用或者液质联用技术,对于药企来说,检测成本增加。在实际操作时,上述问题可通过改变溶剂的组分使供试品溶液成分析出,将高浓度的基质除去,以降低基质干扰。
5.2. 基因毒性杂质的种类繁多且理化性质差异较大
一个药物中可能含有多种类型的基因毒性杂质,在进行测定时,可能就需要建立多种检测方法对其分别进行测定,将得到的检测结果进行对比,相互补充,才能满足其检测要求。
5.3. 基因毒性杂质的稳定性较差
由于基因毒性杂质大多数具有活泼的官能团,自身容易发生氧化、水解或还原反应,或者与其他物质发生反应,故在测定时需进行衍生化或加入稳定剂 [31]。
5.4. 基因毒性杂质的溶解性
为了确保检测结果的可靠性,一般要求选择合适的溶剂体系,既要使潜在的基因毒性杂质完全溶解,同时也要保证所选择的溶剂对待测物质无干扰。
5.5. 杂质评估不充分
药企对药物合成路线中的基因毒性杂质的来源评估不充分忽略了在原始物料、反应中间体以及制剂的贮存和运输等因素会产生潜在的基因毒性杂质。
5.6. 计算机理论预测比较单一化
对于未经检测的降解杂质产物不应仅根据计算机或理论预测进行研究,而应重点研究通过强制性降解试验、加速或长期稳定性研究观察到的降解途径和主要降解产物 [32];目前关于如何识别、预测和处理合成过程中形成的基因毒性杂质的文献报道较多,如替尼类药物的N-氧化物、硝基苯催化氧化还原反应及副反应的控制、过渡金属杂质的处理等,但目前还没有统一的策略和方法,已经成为制约国内基因毒性杂质研究的瓶颈。
6. 结语
充分的杂质研究是制定科学合理的质量标准的基础,也是药品安全、有效、质量可控的重要保证。加强药品研发和质量控制,特别是对药品中所含基因毒性杂质的有效控制,将其限度控制在一个可接受的范围内,保证药品质量,减少不良反应的发生。是当前的首要任务。
HPLC-MS联合技术具有分离效率高、速度快、灵敏度高、选择性好等优点。它不仅具有色谱的优点,而且可以给出丰富的结构信息,提高其定性能力,可以寻找和鉴定药物中基因毒性杂质的最佳条件,是目前有效控制药物质量的最重要的分析工具之一。同时,在药物定性鉴定、体内代谢物研究、中药复杂成分分析等领域发挥着重要作用。随着色谱及其联用技术的不断进步,各种技术相互配合和补充,将成为未来药物杂质研究的主流。
随着科技的发展,对致癌、致突变等遗传毒性杂质的研究越来越深入,也将会出现新的遗传毒性杂质结构,现有遗传毒性杂质的控制限度和控制方法也会随之做出相应的调整。因此,应关注基因毒性杂质在药品整个生产周期的研究进展,与时俱进地开展研究,制定合理的控制策略。