1. 引言
光合作用是“地球上最重要的化学反应”,它是绿色植物和蓝细菌利用光能将二氧化碳和水合成有机物并释放氧气的过程,为几乎所有的地球生命活动提供有机物、能量和氧气。每年地球上通过光合作用合成的有机物约为2200亿吨,相当于人类每年所需能耗的10倍,是作物及生物质能的物质基础 [1]。
光合作用的载体是叶绿体,绿色植物进行光合作用的前提条件是叶绿体的正常发育,这一过程受到细胞核、叶绿体基因组控制,并被多种途径所调控。叶绿体中的叶绿素(Chlorophyll, Chl)在收集传递光能以及驱动电子传递过程中起着重要的作用。每年约有109数量的叶绿素伴随着季节的交替而合成降解,一年同化的碳素相当于四五千亿吨的有机物质,因此叶绿素的合成和降解是地球上最重要的一种生化反应 [2]。
叶绿素的光吸收特性使其很容易产生对细胞具有破坏性的光毒性,这一现象在高光条件下的叶肉细胞中很容易观察到。叶绿素在吸收光能产生氧气的同时,也会产生一部分活性氧,活性氧大量积累会引起细胞凋亡,给植物带来不可逆的伤害 [3]。所以叶绿素的新陈代谢受到高度精密的调控。已有大量研究表明,在植物发育衰老的过程中,叶绿素的降解是由基因组高度调控的 [4]。
2. 叶绿素的代谢过程
2.1. 叶绿素的合成
高等植物的叶绿素生物合成是由一系列酶促反应组成的。通过前人大量的研究和报道,控制高等植物叶绿素生物合成的基因及其编码的酶已被鉴定出,共有15种酶参与催化 [5]。如图1所示,叶绿素的生物合成过程主要可以分为三个部分:1) 合成δ-氨基酮戊酸(ALA);2) 8分子ALA合成原卟啉原Ⅸ;3) 完成后续叶绿素合成步骤。合成反应的起始步骤是在叶绿体基质中合成ALA。谷氨酸在谷酰胺tRNA还原酶(GluTR)和谷氨酸-1-半醛转氨酶(GSA-AT)催化下生成ALA。这是调控叶绿素合成速率的关键步骤,其中的GluTR是关键酶 [6]。
此后,8分子ALA先后在δ-氨基酮戊酸脱氢酶(ALAD)、脱乙酰壳多糖脱氨酶(PBD)、尿卟啉原Ⅲ合酶(UroS)、尿卟啉原Ⅲ脱氢酶(UroD)和粪卟啉原氧化酶(CPO)的催化下,先后生成胆色素原、尿卟啉原Ⅲ和粪卟啉原Ⅲ,最终生成1分子原卟啉原Ⅲ。以上反应的进行,使亲水的谷氨酸逐渐转变为疏水的原卟啉原Ⅲ,同时开始具备一定光敏性,反应的进行场所逐渐由叶绿体基质转移到类囊体膜。在线粒体和类囊体膜上,可以同时检测到原卟啉原氧化酶(PPX)的活性,这种酶可以催化原卟啉原Ⅲ转化为原卟啉Ⅸ。在线粒体中,原卟啉Ⅲ在铁螯合酶(FeCh)催化下与铁螯合,生成亚铁血红素;在类囊体中,在镁螯合酶(MgCh)催化下与镁螯合,生成Mg-原卟啉Ⅸ。因此在形成原卟啉IX后,合成途径便产生两条分支,一条是形成叶绿素,一条是形成亚铁血红素。
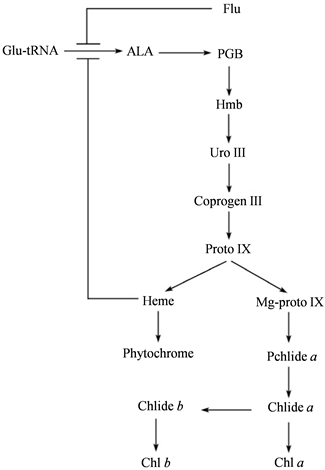
Figure 1. Chlorophyll a synthesis mechanism diagram [6]
图1. 叶绿素a合成机理图 [6]
Mg-原卟啉Ⅸ在Mg-原卟啉Ⅸ甲基转移酶(MTF)、Mg-原卟啉Ⅸ单甲酯环化酶(MTC)和8-乙烯基还原酶(VR)的催化下,接受S-腺苷甲硫氨酸的甲基而产生环戊酮环,生成原脱植基叶绿素a。原脱植基叶绿素a在NADPH-原脱植基叶绿素氧化还原酶(POR)催化下,被还原成脱植基叶绿素a。POR酶是由小基因家族编码的,在拟南芥中,PORA是黑暗诱导的,PORB本底性表达,PORC受光诱导。原脱植基叶绿素a、NADPH、POR形成的三元复合物,是白色体向叶绿体转化的关键。此后在叶绿素合成酶作用下,最终生成叶绿素a [3] [7] [8] [9] [10]。
2.2. 叶绿素循环
在叶绿素b的形成上,主要进行的是原脱植基叶绿素a向原脱植基叶绿素b的转变,也有一部分叶绿素b,是叶绿素a在叶绿素a加氧酶(CAO)的催化下直接发生转变的。叶绿素b也能在叶绿素b还原酶(CBR)、羟基叶绿素a还原酶(HAR)催化下再次转变为叶绿素a。此后的研究发现叶绿素b还原酶是两种不同的短链,分别称为NON-YELLOW COLORING1 (NYC1)和NYC1-LIKE (NOL),这两种蛋白以异聚肽的形式形成复合物,催化叶绿素b还原。这种原脱植基叶绿素a与原脱植基叶绿素b,或叶绿素a与叶绿素b的互相转变,称为叶绿素循环 [11] [12] ,如图2所示。
这种循环可以帮助植株更好地适应光照发生改变的环境,因为叶绿素a和叶绿素b具有不同范围地吸收光谱,能使植物最大效率地利用不同强度的光照能量。叶绿素b向叶绿素a的转化是早期叶绿素降解的重要步骤 [13] [14]。
2.3. 叶绿素的降解
叶绿素降解机理因其所处环境的不同而异,长时间受光辐射、黑暗诱导、组织衰败、果实成熟、逆
境胁迫等均会引起叶绿素降解。在叶片衰老过程中叶绿素不断分解,导致叶绿素和类胡萝卜素的比例发生变化而使叶片呈现出黄色。叶绿素的降解可以大致分为两个部分:1) 有色组件转化成初级荧光叶绿素代谢物(pFCC);2) pFCC经非酶促异构化修饰,转化为非荧光叶绿素分解代谢物(NCC),被运至液泡进一步降解为单吡咯 [15] [16]。
叶绿素a在脱镁螯合酶作用下释放中心Mg原子,生成脱镁叶绿素a。脱镁叶绿素a在脱镁叶绿素酶(PPH)的催化下脱去植醇,生成脱镁叶绿酸a。体外实验分析表明,脱镁叶绿酸被进一步降解为初生荧光叶绿素代谢物(pFCC)。在pFCC中,脱镁叶绿酸的卟啉大环在吡咯A和B之间已被氧分解。这一反应可分为两个步骤:第一步是脱镁叶绿酸a在定位于叶绿体内膜的脱镁叶绿酸a氧化酶(PAO)的催化下,形成红色叶绿素降解产物(RCC)。第二步是在RCC还原酶(RCCR)催化下形成pFCC。由于PAO是整个叶绿素降解过程的关键酶,因此叶绿素降解过程也可以叫作PAO途径。
进一步的研究表明,体外pFCC (半衰期为30分钟)在pH为4.9时互变异构化到相应的非荧光叶绿素分解代谢物(NCC)。pFCC在叶绿体基质中经过几次修饰之后,经ABC运载体运输至液泡中,在液泡的酸性环境中发生非酶学异构形成最终的NCC,最后转化成单吡咯,至此完成叶绿素的降解 [10] [15] [17] [18] [19] [20]。
3. 叶绿素代谢的调控
3.1. 叶绿素合成的调控
已有大量研究从基因表达、生理生化方向揭示了叶绿素生物合成的调控途径。对于叶绿素的生物合成调控,能在基因表达变化水平上较明显地观察到,其能影响到相应调节蛋白的浓度,进而对叶绿素生物合成起调控作用 [14]。
GluTR是催化叶绿素生物合成的第一个酶,大量证据表明该酶的活性受细胞内亚铁血红素含量的调控。但同样有其他调控机制在发挥作用,FLU就是其中之一。FLU是第一个被鉴定为四吡咯生物合成的潜在调节因子,研究表明FLU能调控GluTR的活性,酵母双杂交证明FLU能与GluTR直接发生作用,调控四吡咯的合成 [21]。
GUN4首次在缺失质核信号的拟南芥突变体上被鉴定到。序列分析显示,GUN4的N端并不是高度保守,暗示GUN4的功能不止是调节叶绿素合成;其C端具有较高的结构和空间保守性。虽然C端结构具有相似性,但其开放性和原卟啉Ⅸ结合位点是不一样的。GUN4在被细胞积累时将与原卟啉Ⅸ结合,通过调节质核信号的方式对叶绿素合成进行调控,使植物感光。
PIF1是一个螺旋–转角–螺旋蛋白,免疫沉淀分析发现PIF1能与光敏色素A和B发生作用,但在与DNA结合后,这种作用并未发生。由此推测PIF1是叶绿素合成的负调控因子,但活化的色素会干扰PIF1的功能。
有研究还发现拟南芥叶绿体的发育受一对GLK基因调控。GLK蛋白是转录因子超家族的成员,系统发育分析表明GLK基因对在单子叶植物和双子叶植物中进行单独复制。GLK基因可以调节不同植物的叶绿体发育 [22]。
3.2. 叶绿素降解的酶调控
叶绿素在降解过程中会形成很多中间代谢产物,由于各类叶绿素降解酶(CCEs)的催化调节作用,这些代谢物能按一定方向和速率有序发生反应,最终完成叶绿素到四吡咯的降解过程。目前已知六种叶绿素降解酶,分别是NOL、NYC1、HAR、PPH、PAO和RCCR,以及一种金属螯合物MCS参与叶绿素降解。编码这些酶的基因已先后在水稻、拟南芥等模式作物中被鉴定,它们的转录表达情况一旦发生改变,就会影响到叶绿素降解,进而体现出叶片黄化或衰老的表型变化。
除了CCEs对叶绿素降解的直接调控外,一些调控内源激素的酶也能进行间接调控。赤霉素(GAs)是高等植物中的一种重要的内源激素,在打破休眠、促进营养生长、防止器官脱落等方面发挥作用。GA2氧化酶能促进赤霉素及其前提物质的失活和降解,有效降低植物体内赤霉素含量。BnGA2ox6是编码GA2氧化酶的基因,能促进赤霉素失活降解,间接影响叶绿素生物合成;并且能直接调控叶绿素降解酶的基因表达,抑制叶绿素降解 [13] [23] [24]。
3.3. 叶绿素降解的持绿蛋白(SGR)调控
持绿蛋白(STAY-GREEN Proteins, SGR)是叶绿素降解过程的关键调控因子,其功能独立于PAO酶。序列比对分析显示持绿蛋白是一种高度保守的蛋白,检测不到任何特征域,推测其作为调节蛋白参与调节叶绿素降解,而不具备酶的功能 [25]。
SGR在高等植物中通常具有两个及以上的同系物。系统发育分析显示SGR蛋白家族可以分为两大类:一类是真实的SGR亚家族,其突变体具有持绿表型;一类是SGR-LIKE亚家族(SGRL),与SGR有较大差别,但在不同植物中高度保守。在拟南芥、水稻、豌豆、番茄、甜椒、高羊茅、苜蓿和大豆等植物中,SGR1直系同源物的突变均会产生持绿的表型。
SGR1和SGR2的表达在自然衰老和暗诱导衰老期间表达均增加,但却具有相反的功能。SGR1以及SGR2均与LHCⅡ相互作用,但不同的是,SGR2与叶绿素降解酶的相互作用十分有限。此外,SGR1与SGR2形成同二聚体或异二聚体,干扰SGR1与叶绿素降解酶的相互作用,在叶绿素降解中起负调控作用,平衡叶绿体中的叶绿素分解代谢 [26]。
4. 展望
植物光合作用的意义在于:首先,制造了有机物,为人类和动物的生存提供了保障;其次,实现了转化并储存太阳能的过程,为地球上的生物提供了直接或间接的能源;然后,使得大气中的氧和二氧化碳的含量相对稳定;最后,光合作用对生物的进化具有重要的作用。
叶绿体作为光合作用的载体,其发育和调控机制非常复杂,受到多种因素的影响,其中叶绿素的代谢作为发育过程中主要的内部条件之一,对其进行深入研究,能够完善人们对叶绿素结构功能的认识。
综上所述,光合作用研究,与农业、能源、环境科学与技术的发展密切相关。在现有的基础上有望取得新的研究成果,为农业、能源和环境的可持续发展提供强大的推动力。围绕叶绿体发育开展的研究方向可促进光合作用研究成果在农业和能源等科学中做出重要贡献。