1. 引言
丙酮酸脱氢酶复合体(Pyruvate Dehydrogenase Complex,PDC)催化丙酮酸的氧化脱羧,生成乙酰-CoA和NADH [1] 。乙酰-CoA是三羧酸循环的起始底物,也是脂肪酸合成的底物。PDC除了定位于线粒体,在质体中也有分布,但只有线粒体丙酮酸复合体(mtPDC)通过磷酸化/去磷酸化的方式,失活/激活其酶活性。丙酮酸脱氢酶激酶(Pyruvate Dehydrogenase Kinase, PDK)通过磷酸化PDC上的E1α亚基的Ser残基,失活PDC [2] 。在拟南芥中,AtPDK还会自磷酸化自身的Ser残基,但是当His121和His168突变为Gln时,其自磷酸化能力下降80%左右 [3] 。
动物有4个PDK基因,在生长发育和疾病发生过程中起着重要的作用,更是肿瘤治疗的新靶标基因 [4] 。而在植物中普遍只有1~2个PDK基因,拟南芥和油菜只有1个PDK基因 [5] [6] ,玉米和水稻有2个PDK基因 [7] [8] 。AtPDK通过负调控PDC的活性,与拟南芥的脂肪酸含量呈负相关 [9] ,Zou等 [10] 应用反义mRNA技术抑制拟南芥PDK的表达,在PDC蛋白的表达量没有明显增加的情况下,由于PDK表达量的降低,使得PDC的酶活性得到增加,转基因拟南芥表现为植株生长加快,花期提前,种子重量及含油量增加。在油菜中PDK同样调控油菜种子的脂肪酸合成,过表达油菜PDK1基因,转基因油菜种子的含油量降低 [6] 。在水稻中有两个PDK基因,OsPDK1主要在叶片中表达,而OsPDK2在各个器官中组成型表达,各自起着不同的生物学功能。OsPDK1的RNAi转基因植株,其线粒体丙酮酸脱氢酶的活性是野生型的2倍,植株比野生型矮10%~30% [8] 。
橡胶树的异戊二烯单体来源于异戊烯基焦磷酸(isopentenylpyrophosphate, IPP),而IPP的底物是乙酰–辅酶A [11] ,因而橡胶树PDK很可能会通过调控PDC的活性而影响乙酰辅酶A的生成,进而调控橡胶树橡胶烃的合成。本研究从橡胶树中获得了一个丙酮酸脱氢酶激酶基因HbPDK,分析了HbPDK在橡胶树胶乳中的表达特征,并利用原核表达体系,获得了高纯度的重组蛋白,该项工作为揭示HbPDK的功能奠定了基础。
2. 材料和方法
2.1. 材料
2.1.1. 实验材料
实验用树为10年生、开割3年的未进行乙烯利刺激割胶的热研7-33-97品系,定植于中国热带农业科学院试验场1队。采集了八个不同组织和不同发育时期叶片;用1%乙烯利涂抹在胶线和胶线上部1~2 cm处的树皮上处理后的12小时、24小时和48小时分别割胶,采集胶乳。
2.1.2. 实验试剂和菌种
Taq DNA聚合酶和大肠杆菌感受态DH5α和Rossetta (DE3),荧光定量试剂TransStart Tip Green qPCR SuperMix,ProteinIso Ni-NTA Resin为北京全式金生物技术有限公司产品,蛋白预染marker,限制性核酸内切酶、反转录试剂盒为美国Thermo Scientific公司产品。通用植物总RNA提取试剂盒为北京百泰克生物技术有限公司产品。原核表达载体pET32a为本实验室保存。引物和测序均在华大基因完成。
2.2. 方法
2.2.1. 总RNA的提取及cDNA第一链的合成
巴西橡胶树胶乳总RNA的提取方法参照Tang等 [12] ,其它组织的总RNA的提取,使用百泰克公司的通用植物总RNA提取试剂盒。cDNA第一链的合成使用Thermo Scientific公司的RevertAid First Strand cDNA Synthesis Kit,操作步骤依照产品说明书进行。
2.2.2. HbPDK基因的克隆
使用拟南芥AtPDK和ZmPDK1的氨基酸序列tblastn搜索巴西橡胶树的转录组和基因组数据库,发现在橡胶树中只有一个PDK基因。根据mRNA序列,设计了一对基因特异性引物HbPDK-F和HbPDK-R,以树叶和胶乳的cDNA为模板,进行RT-PCR扩增。PCR产物经琼脂糖凝胶电泳和胶回收后,连接到pMD-18T载体中,转化DH5α感受态细胞,挑选5个经菌落PCR鉴定的阳性克隆,送华大基因进行测序验证。引物序列见表1。

Table 1. The sequences of all primers used in this paper
表1. 本文所用的引物及序列
2.2.3. HbPDK的进化树分析
使用Mega7.0 [13] 对橡胶树HbPDK的氨基酸序列,与木薯(XP_021607932.1),麻风树(XP_012084195.1),大豆(XP_003546545.1),可可(XP_007035981.1),棉花(XP_016731482.1),油菜(NP_001302545.1),拟南芥(AtPDK),金丝小枣(XP_015900132.1),番茄(XP_004252952.1),水稻(OsPDK1和OsPDK2),玉米(ZmPDK1和ZmPDK2),油棕(XP_010943866.1)和大麦(BAJ85210.1)的PDK基因的氨基酸序列进行进化树分析,应用Neibgbber-Joining法进行分子系统学分析,并进行1000次bootstrap统计学检验。
2.2.4. HbPDK基因的表达分析
根据HbPDK的mRNA序列,分别设计基因三对荧光定量引物,经溶解曲线和标准曲线分析,确定qPDK-F1和qPDK-R1为最终荧光定量引物,PCR产物经胶回收,构建到pMD-18T中,送公司测序验证。参照Li等 [14] 的方法,使用伯乐公司的CFX96 TOUCH实时荧光定量PCR仪,分析HbPDK基因在橡胶树不同组织、叶片不同时期,以及随着新开割树前8刀割胶后其在胶乳中的表达情况以及当受乙烯利处理4个不同时间后的表达特征参照前期研究,分析不同组织和叶片不同时期的表达情况时,选用的内参基因为RH2b,胶乳内的表达特征,选用的内参基因是YSL8 [15] 。荧光定量分析获得不同处理条件下的HbPDK和内参基因的Cq值,使用SPSS 13进行统计学分析。
2.2.5. HbPDK原核表达载体的构建与表达
以yPDK-F和yPDK-R为引物,含HbPDK基因全长cDNA序列的质粒为模板,使用TaKaRa公司的PrimeSTAR HS DNA Polymerase扩增HbPDK基因的编码区序列。PCR扩增产物使用限制性内切酶Pml I和Sal I双酶切,原核表达载体pET32a使用EcoRV和Sal I双酶切,酶切产物经琼脂糖凝胶回收、连接转化DH5α感受态。挑选阳性克隆,DNA测序确认正确的克隆,成功构建了HbPDK基因在pET32a中的原核表达载体,pET32-HbPDK,重组蛋白命名为Trx-HbPDK。构建完成的原核表达载体转化大肠杆菌表达菌种Rossetta (DE3),待含有pET32-HbPDK质粒的大肠杆菌培养至OD600为0.4~0.6左右时,加入终浓度为0.5 mM的IPTG,20℃诱导12小时。
2.2.6. HbPDK重组蛋白的纯化
IPTG诱导后的Rossetta (DE3)菌经超声破碎后,4℃,13,000 rpm,10 min高速离心,吸取上清至新的离心管,沉淀用相同体积的无菌水重悬,12%聚丙烯胺浓度的SDS-PAGE检测重组蛋白在上清和沉淀中的表达。因为pET32a带有His标签,使用全式金公司的ProteinIso Ni-NTA Resin的镍柱亲和层析介质,从上清中纯化重组蛋白Trx-HbPDK,使用方法参照产品说明书。
3. 结果与分析
3.1. HbPDK基因全长cDNA序列
HbPDK全长cDNA的测序结果显示,其全长cDNA序列为1377 bp,其中编码区长1110 bp,编码369个氨基酸序列,分子量为41.9 kD,ExPASy的ProtParam tool分析其等电点为6.68。用Mega7.0 [13] 对橡胶树、拟南芥、水稻和玉米等PDKs做进化树分析,HbPDK归于双子叶亚类,与同为大戟科的木薯、麻风树的PDK同源性最高(图1)。应用在线预测软件TargetP,Signal P和MITOPROT ,分析HbPDK的氨基酸序列,其不同于哺乳动物的PDKs,没有明显的线粒体信号肽 [16] [17] 。但是MITOPROT,ProtComp和TargetP都预测HbPDK定位于线粒体上 [16] [17] [18] 。
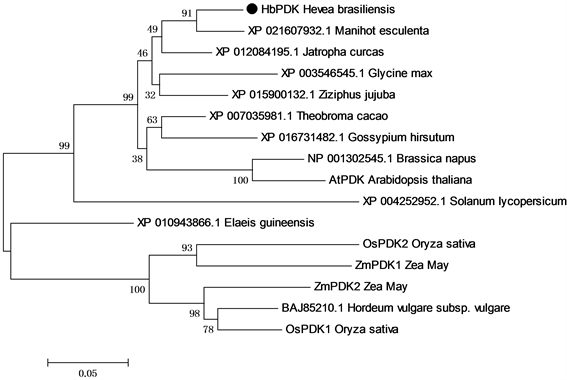
Figure 1. The phylogenetic analysis of HbPDK
图1. HbPDK的进化树分析
3.2. HbPDK基因在不同组织、叶片和胶乳中的表达分析
实时荧光定量PCR分析结果显示,HbPDK基因主要在巴西橡胶树的叶片、胶乳和花中表达(图2)。HbPDK基因在不同发育时期的橡胶树叶片中的表达变化不明显(图3),乙烯利刺激割胶使HbPDK在胶乳中呈轻微下调表达(图4),而割胶却明显下调HbPDK的表达(图5)。
3.3. HbPDK在大肠杆菌中的重组表达
原核表达载体pET32a的Trx标签为105个氨基酸,能够有效的促进外源蛋白在大肠杆菌的表达。SDS-PAGE电泳结果显示,Trx-HbPDK在上清和沉淀中都大量表达,其表达量占上清总蛋白的50%以上。相对于玉米 [7] 的PDK1,PDK2使用His标签,95%的重组表达蛋白在沉淀中表达,Trx标签明显促进了HbPDK的可溶性表达。应用镍柱亲和层析,纯化上清中的Trx-HbPDK蛋白,得到了纯度在90%的融合蛋白。
4. 讨论
橡胶树HbPDK基因在根和树皮中表达量很低,而叶片中的表达量最高(图2),并且在叶片发育的各个时期表达量比较稳定,这和水稻的OsPDK1和玉米的ZmPDK2主要在叶片中表达很相似,这可能与植物叶片光呼吸产生的大量ATP相关 [7] [8] 。橡胶树随着割胶次数的增加,产量逐渐增加,但每次割胶,乳管细胞损失了大量的细胞质、亚细胞器和营养物质,为了快速恢复橡胶的合成和其它生物物质的生成,乳管细胞必然进行快速的代谢活动。HbPDK作为PDC的负调控因子,割胶条件下,HbPDK的表达量明显下调,在第二刀就下降了50%左右(图5),从而减少了PDK对PDC的抑制作用,增强了PDC的活性,促进乙酰辅酶A的合成。乙酰辅酶A除了是柠檬酸循环的底物,还是脂肪酸和橡胶烃合成的起始底物,在橡胶树中乙酰辅酶A通过甲羟戊酸途径生成异戊烯基焦磷酸(IPP),而IPP是橡胶烃合成的前体。
其它植物的PDK基因的表达受到激素的调控,在水稻中,GA能上调OsPDK1的表达,使得PDC的活性下降50%左右,而其它激素(IAA,BA,BL等)对PDK1的表达基本无影响 [8] ,ABA还能下调OsPDK1

Figure 2. Expression of HbPDK in different Hevea tissues. 1: Latex, 2: Leaf, 3: Bark, 4: Male flower, 5: Female flower, 6: Seed, 7: Root, 8: Young bark
图2. HbPDK基因在橡胶树不同组织中的表达分析。1:胶乳,2:叶片,3:树皮,4:雄花,5:雌花,6:种子,7:根,8:嫩茎树皮

Figure 3. Expression of HbPDK in different stages of Hevea leaf development. 1: Bronze leaf, 2: Color change leaf, 3: Pale-green leaf, 4: Mature leaf; the relative expression of Color change leaf is 1.0
图3. HbPDK基因在橡胶树叶片不同发育时期的表达分析1:古铜期叶片,2:变色期叶片,3:淡绿期叶片,4:稳定期叶片
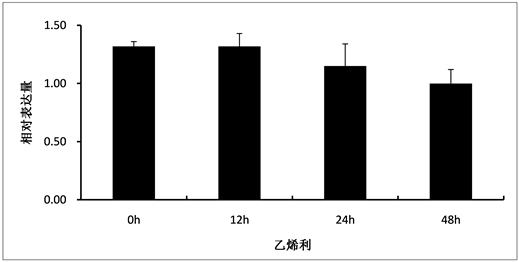
Figure4. Expression of HbPDK in Hevea latex under 1% ethrel treatment
图4. HbPDK在1%乙烯利刺激割胶条件下叶片中的表达分析
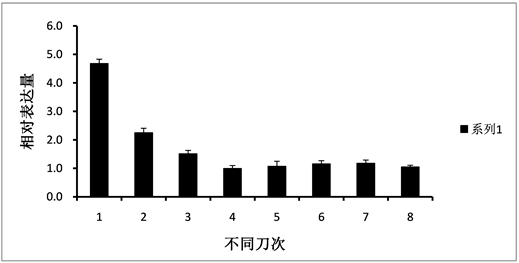
Figure 5. The expression of HbPDK during eight successive tapping on Hevea brasiliensis virgin trees
图5. HbPDK在橡胶树新开割树前8刀的表达分析

Figure 6. The SDS-PAGE electrophoresis of HbPDK recombinant protein. M: Prestained Protein Marker, 1: The supernatant of pET32-HbPDK, 2: The precipitate of pET32-HbPDK; 3: The purified recombinant protein. Where the arrows point is the recombinant protein
图6. HbPDK重组蛋白的SDS-PAGE电泳图片。M:预染蛋白marker,1:pET32-HbPDK超声破碎后上清,2:pET32-HbPDK超声破碎后沉淀,3:pET32-HbPDK镍柱纯化后的目的蛋白,箭头所指为重组蛋白Trx-HbPDK
的表达。通过在橡胶树树干的割胶部位涂抹乙烯利,乙烯利释放乙烯,刺激橡胶产量的增加,是橡胶树增产的重要方式,但乙烯利处理,HbPDK的表达量只有轻微的下调(图4)。乙烯利增产很可能不是通过下调HbPDK的表达来达到增产的目的。也可能是割胶刺激后,HbPDK的表达已经达到了一个较低的表达水平,乙烯利不能进一步下调HbPDK的表达。
割胶刺激显著增加橡胶树胶乳的产量,而随着割胶次数的增加,HbPDK的表达量明显减少,HbPDK是割胶增产的负调控因子,通过调控乙酰辅酶A的生成而增加橡胶树产量。本实验还获得了较高纯度的HbPDK的重组蛋白(图6),为下一步研究HbPDK蛋白的功能奠定了一定的基础。
基金项目
中国热带农业科学院基本科研业务费专项资金(1630022018019和1630022017001)支持。
NOTES
*通讯作者。