摘要:目的:通过挖掘美国食品药品监督管理局不良事件呈报系统(FDA adverse event reporting system, FAERS)数据库中关于艾曲波帕(ETP)的相关数据,探讨该药潜在的不良反应,为临床安全用药提供依据。方法:提取FAERS数据库2017年第1季度至2022年第4季度共24个季度中上述药物的报告,运用报告比值法(ROR法)和综合标准法(MHRA法)联合检验,再利用MedDRA术语集汉化及系统器官归类对结果标化。结果:共检出21,666次以ETP为首的不良事件(ADE)报告,检测得到18,761个有效ADE信号,共累及27个不同系统器官(SOC),主要集中在各类检查、全身性疾病及给药部位各种反应、胃肠系统疾病等。结论:临床应用ETP药物时需监测患者血小板变化情况,密切监护患者生命体征;具有骨髓网状纤维化等相关基础疾病的患者需加强评估,以保证临床合理用药。
Abstract:Objective: To explore the potential adverse reactions of eltrombopag by (ETP) mining the FDA adverse event reporting system (FAERS) database to provide evidence for the safe use of these drugs in clinical settings. Methods: The reports of the above-mentioned drugs in the 24 quarters from the first quarter of 2017 to the fourth quarter of 2022 were extracted from the FAERS database, and the reported ratio method (ROR method) and the comprehensive standard method (MHRA method) were used to jointly test, and then use the MedDRA terminology set Chinese and system organ classification standardized the results. Results: Totally 21,666 ADE with ETP as the primary suspected drug were retrieved as the original data. A total of 18,761 ADE signals were obtained from the ETP. The signals involved 27 different system organs (SOC). The ADEs of different ETP was mainly involved in “various types of tests”, “systemic disease and various reactions at the site of administration” and “gastrointestinal diseases”. Conclusion: The clinical use of ETP requires monitoring of blood and the vital signs of patients were closely monitored, white blood cell counts, ptients with underlying diseases such as myeloreticular fibrosis need to be evaluated to ensure rational drug use.
1. 前言
艾曲泊帕(eltrombopagby, ETP)为二代促血小板生成药,也是唯一获批治疗免疫性血小板减少症(immune thrombocyto-penia, IPT)的口服小分子、非肽类血小板生成素受体(thrombopietin receptor, TPO-R)激动剂,但该药物在带来生存获益的同时,也会对其他正常组织造成不同程度的损害 [1] ,限制其临床应用。美国FDA不良事件报告系统(FDA Adverse Event ReportingSystem, FAERS)是一个公开的网络数据库,美国食品和药品管理局自呈报系统是其报告来源,现已成熟应用于药物警戒研究领域 [2] 。虽然国内外对ETP药物安全性相关报道众多 [3] [4] ,而这些对ETP不良事件(Adverse drug event, ADE)的分析局限于文献报道和临床观察研究,缺少信号挖掘研究。因此,笔者通过数据挖掘寻找ETP的ADE信号,发现新的ADE信号,弥补说明书不足,为安全用药提供参考。
2. 资料与方法
2.1. 数据来源
在FAERS数据库中提出2017年第1季度至2023年第3季度共27个季度的数据文档,包括人口统计信息、药品使用信息、反应术语、疑似药物的治疗起止日期、患者结局、报告来源、用药指征及删除病例,导入MySQL软件,去重并筛选出用药名称为“ELTROMBOPAG”、“PROMACTA”、“ELBONIX”、“ALVAIZ”为“首要怀疑药物”的报告。
2.2. 计算方法
运用比例失衡法中的报告比值法(ROR法)和综合标准法(MHRA法)联合检验,计算ROR值、PRR值和x2,数值越大信号强度越高;即目标药物与目标ADE间的统计学相关性越强,见表1、表2。

Table 1. Fourfold table of measures of disproportionality
表1. 比例失衡法所用四格表

Table 2. Formulas and threshold values of ROR and MHRA
表2. ROR法和MHRA法公式及阈值
2.3. 标准化
将结果按照《药事管理标准医学术语集》(Medical Dictionary for Regulatory Activities, MedDRA)中药物不良反应术语集的首选术语(preferred term, PT)相匹配,再对照首选系统器官分类(system organ class, SOC)进行映射 [5] 。
3. 结果
3.1. ADE报告的基本信息
目标时段共计ADE报告21,666例,其中ETP为首要怀疑药物的唯一报告有2009例,见表3。由表可见ADE上报人数中,男女比例相差不大。在已知年龄的患者中,主要集中在65岁以上患者,构成比为30.91%。上报国家以美国为主,构成比为65.01%。

Table 3. Basic information of ADE reports
表3. ADE报告的基本信息
3.2. ADE信号累及系统器官分类
去重后得到阳性信号共610个,共累及27个SOC (见图1)。其中,ETP的信号累及全身性疾病及给药部位各种反应的报告居首位,共4810例,构成比为25.64%;其次是各类检查,共计2972例,约占15.84%;第三位是胃肠系统疾病,共有1460例,约占7.78%,余下依次为各类神经系统疾病、代谢及营养类疾病、良性、恶性及性质不明的肿瘤、呼吸系统、胸及纵隔疾病、感染及侵染类疾病、心脏器官疾病、血管与淋巴管类疾病等。
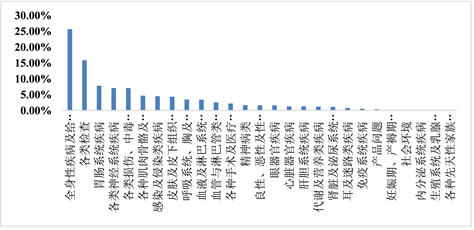
Figure 1. Proportion of reported cases of ETP involving systemic ADE
图1. ETP累及器官系统ADE发生例数构成比
3.3. ADE报告和信号情况
ETP共检出阳性信号254个,共累及27个系统器官按报告数和信号强度(ROR值的95% CI下限)对前20位PT排序,见表4和表5,其中骨髓网状纤维化的信号强度最强,ROR为592.7956119,且未在说明书中收录。其次为血小板计数升高或降低,阵发性夜间血红蛋白尿。报告数量前20位PT排序可发现死亡的报告数量最多,为1667个。

Table 4. Top 20 PTs by signal strength
表4. 信号强度前20位PT排序

Table 5. Top 20 PTs by the number of reports
表5. 报告数量前20位PT排序
注:*为说明书中未收录的药品不良事件。
4. 讨论
本研究通过FAERS数据库对EPT ADE信号进行挖掘,共得到首要怀疑药物为21,666例,上报国家以美国为主;本研究纳入的报告中,ETP不良事件发生均集中于65岁以上,这可能提示老年是否为ETP不良事件发生的危险因素需进一步验证。
ETP产生的ADE信号与药品说明书 [6] 重合性较好,证明了本研究方法的可靠性。其结果显示:a. SOC项分布广泛;比较相似的是在胃肠系统疾病,全身性疾病及给药部位各种反应项中两药ADE构成比都较大,包括疼痛,发热,乏力等4809个PT,其中,上报例数最多的为死亡,共计1667例(ROR = 111.57, X2= 30991.18),信号强度较高,虽然这与患者本身的基础疾病可能相关,目前尚无关于艾曲波帕使用后直接导致死亡的文献报道,但也提示临床在用药过程中需密切监测血压、脉搏、呼吸等生命体征 [7] 。
此外,值得注意的是EPT说明书提示该药无需根据患者肾功能情况调整用药剂量。本文研究结果显示EPT致肾脏及泌尿系统疾病的上报病例较多,共计202例,其中肾功能损害28例(ROR = 3.62, X2= 52.23),肾衰28例(ROR = 2.06, X2= 51.73),肾脏疾病26例(ROR = 5.79, X2= 101.79)。但目前尚无ETP在肾脏系统方面安全性的更多报道和数据,但临床在用药过程中仍需监测。研究数据显示ETP致骨髓网状纤维化的95% Cl (ROR)下限最高,说明骨髓网状纤维化的发生和ETP的使用高度相关。骨髓网状纤维化是一种骨髓增生性肿瘤(MPN) [8] ,其特征是干细胞来源的克隆性骨髓增生,通常但并非总是伴有JAK2、CALR或MPL突变;其他特征包括骨髓网状蛋白/胶原纤维化、炎性细胞因子表达异常、贫血、肝脾肿大、髓外造血(EMH)、全身症状、恶病质、白血病进展风险和生存期缩短;当巨核细胞受到刺激时,它们会释放转化生长因子-β和其他细胞因子,促进成纤维细胞合成胶原蛋白 [9] 。也有学者 [10] 认为是通过骨髓中血小板生成素的过表达诱导的巨核细胞刺激而发生的。一项回顾性研究结果显示 [11] ,2例患者出现中度至重度纤维化。其中一名患者的骨髓检查结果在患者退出研究后逆转。通过使用欧洲共识量表对纤维化程度进行评分,52%的患者并未发生纤维化,41%的患者骨髓纤维化评分为1。目前关于ETP致骨髓网状纤维化的数据有限,但有相关基础疾病的患者在使用ETP仍需谨慎,加强监测。
5. 结论
本研究运用ROR法和MHRA法,将FAERS数据库中ETP不良反应信号进行数据挖掘,其结果与对应的药品说明书重合度较好,也发现了新的说明书未收录的药品不良反应。其ADE累及系统器官存在明显差异,主要与全身性疾病及给药部位各种反应、胃肠系统疾病的关联性更强;以上结果供临床参考。
项目支持
毕科合重大专项(2023)2-1。
NOTES
*通讯作者。