1. 引言
自上世纪70年代能源危机以来,能源系统在近50年一直面对着严峻的挑战和极强的不确定性。加之当前国际环境复杂严峻,世界百年未有之大变局加速演进,世界各国在面对紧迫挑战的同时,需按照签署《巴黎协定》气候目标的要求深度且迅速地实现脱碳。中国作为世界第一大碳排放国也是世界上最大的发展中国家,我国政府充分认识到了绿色转型发展的必要性,并实施积极的应对气候变化国家战略和碳达峰碳中和行动,推动经济社会发展和能源系统全面绿色低碳转型。据国家统计局数据显示,就2022年全年全国消耗能源总量为54.1亿吨标准煤,从能源消耗结构构成中分析,煤炭消耗总量、石油消耗量、天然气消耗量以及一些电力能源和水核风等非化石清洁能源分别占总量的56.2%、17.9%和25.9%。较2021年比较分析此数据可得,煤炭能源消耗量上升0.3个百分点;天然气、水电、核电、风电、太阳能发电等清洁能源消耗量比上年上升0.4个百分点。清洁能源所占比重的不断增长说明我国的在大力发展清洁能源的同时,使我国的能源结构得到不断的优化。清洁能源包括现在大力发展的无碳能源,如太阳能、水能、风能、生物能以及核能等可再生能源以及氨(NH3)、氢气(H2)等无碳分子燃料;还包括一些低碳可燃能源,如天然气(CH4)等 [1] 。
作为兼具较高能量密度(13 MJ/L)和拥有成熟生产、运输和储存技术的无碳燃料,研究表明NH3 [2] 可能是当今和未来研究的热点课题。NH3作为一种能量载体氢,具有质量分数17.8%的H元素即具有较高的氢密度,其能量密度为22.5 MJ/kg和传统化石燃料相当,且理想情况下氨完全燃烧时只产生N2和H2O,没有温室气体碳氧化物排放。但氨火焰速度很慢,最大层流火焰速度为0.07 m/s,比甲烷最大层流火焰速度0.37 m/s低五倍 [3] ,而氢气的最大层流火焰速度大约3 m/s。氨的可燃范围窄,最小点火能量高,以及由于氮原子的存在,可能导致放热速率低,氨火焰稳定特性差,燃烧效率低,燃料型NOx排放高等问题。
针对NH3的高阻燃性以及低的燃烧强度:为了提高NH3燃烧时的层流燃烧速度,目前较为合适的方法是将NH3与燃烧强度较强,火焰传播能力较强的燃料进行混合,组合成诸如NH3/H2或者NH3/CH4之类的二元混合燃料。已有的许多研究表明,在NH3中加入部分的H2和CH4会促进着火以及燃烧特性,并且能增强NH3燃烧时的火焰稳定性。
本研究通过引入一维火焰结构,使用Chemkin软件建立预混层流火焰速度模型将NH3/CH4燃料燃烧的数值模拟结果与现有公开文献中相关条件下的实验结果进行比较,得出目前文献中常见的5种反应机理Konnov、Tian、Glarborg、GRI3.0、Okafor下的数值模拟结果与实验结果之间存在的差异,以及NH3/CH4不同燃料配比下火焰特性的变化趋势,并通过敏感性分析探讨了不同当量比与燃料配比下重要基元反应以及中间产物对层流火焰速度变化的影响。同时,本研究在Okafor机理的基础上优化并提出了一种改进机理。通过本研究可以期望对以NH3/CH4为燃料的燃烧基础理论的发展、不同详细反应机理在NH3/CH4燃烧时如何影响燃烧特性的认知做出一定的贡献,在结合前人研究结果的基础上,为后人的相关研究工作提供经验。
2. 计算细节
2.1. 一维层流火焰结构
Figure 1. Schematic diagram of one-dimensional laminar flame structure
图1. 一维层流预混火焰结构示意图
燃烧火焰可以根据燃料和氧化剂是否预先混合可以分为预混燃烧火焰和非预混燃烧火焰,前者为燃料和氧化剂先混合后燃烧,后者是燃烧和混合同时发生。而根据流体的流动还可以将火焰分为层流火焰和湍流火焰。本研究涉及到的火焰类型为一维层流预混火焰,如图1所示,是在Chemkin软件包中的PLFSC (Premixed Laminar Flame-speed Calculation)模型中完成的,主要用于研究NH3/CH4混合燃料燃烧下的层流燃烧速度的数值分析及其反应机理的优化研究。
2.2. Chemkin软件介绍及参数设置
本研究对一维预混火焰的所有的数值模拟都是采用Chemkin软件中的PREMIX代码完成的,用以研究详细化学反应机理,并且对反应过程进行优化,其模拟工作主要涉及不同条件下NH3/CH4/Air的层流火焰速度(SL)。化学机理以Okafor [4] 机理为主体框架,结合其他几种常用机理 [5] 进行了优化改进。本研究使用Chemkin中的火焰速度PLFSC模型求解未拉伸,绝热自由传播的一维平面火焰中的稳态质量,能量,以及组分守恒方程,网格的梯度和网格的曲率设置为0.01,最大网格数量设置为1500以确保高网格精度下的计算能够收敛;层流火焰的计算区域设置为0~5 cm;为减少计算成本以及降低计算时的收敛难度,在模拟中混合物扩散系数的计算采用平均方法。模拟中对流项的离散采用迎风差分方法。
2.3. 一维火焰控制方程
对于本文讨论的稳态、等压、准一维火焰传播的控制过程,假设在入口条件都是均匀的一维流动,其完整的控制守恒方程如下:
1) 连续性方程:
(1)
2) 能量方程:
(2)
3) 组分方程:
(3)
4) 状态方程:
(4)
式中:x表示空间坐标;
为质量流量,其与坐标无关;
为温度;
为第k种组分的质量分数,
表示共有组分数;P为压力;
为流体混合物的速度;
为质量密度;
为第k种组分的分子量,
为混合物的平均分子量;R为通用气体常数;
为混合物的导热系数;
为混合物的定压比热容,
为第k种组分的定压比热容;
为第k种组分在单位体积下化学反应的摩尔产生速率;
为第k种组分的比焓;Vk为第k种组分的分子扩散速率,
为气体或粒子分子辐射造成的辐射散热损失;A为包围火焰的流管的截面积(通常由于热膨胀而增加)由燃烧器区域标准化。
每一种物质的净化学生成率是由涉及该物质的所有化学反应之间的竞争平衡产生的。假定每个反应都是根据质量作用定律进行的,正向速率系数是修正的阿累尼乌斯形式 [6] (Arrhenius Law):
(5)
注:A为指前因子,
为温度指数,
为活化能。
3. NH3/CH4/Air火焰
3.1. 详细反应机理的对比
3.1.1. 当量比对层流燃烧速度的影响
图2展示了不同燃料比例下,NH3/CH4/Air的层流火焰速度SL随当量比φ的变化趋势,红色、黑色的点线图分别代表通过Okafor机理、GRI-Mech 3.0机理计算得到的结果,空心的散点代表公开文献中,相似条件下的实验数据,实验数据来自Han等 [7] 和Okafor等 [4] 。其中空心的红色圆圈代表二元燃料NH3/CH4中,NH3的摩尔加权热分数为60% (折合成摩尔分数大约为XNH3 = 53.5%)时层流火焰速度的实验数据;蓝色的空心三角形代表二元燃料NH3/CH4中NH3的摩尔分数为80%时的实验数据。XNH3代表NH3在二元燃料中所占摩尔分数表示为:
(6)
式中:nNH3——NH3的摩尔数;
nCH4——CH4的摩尔数。
从图2中可以看出CH4的加入显著提高了混合燃料的层流火焰速度SL,此外,层流火焰速度SL最大值所对应的当量比也会随着燃料组成的不同,在φ = 1.0~1.1之间的富燃料侧内发生着轻微的变化。在XNH3 = 80%时,相较于GRI-Mech 3.0机理模拟计算得到的层流火焰速度SL,通过Okafor机理计算得到的结果在几乎与φ = 0.7~1.2之间的实验数据完全一致,这也表明Okafor机理适用于NH3比例较高的NH3/CH4混合燃料层流火焰速度的计算中。
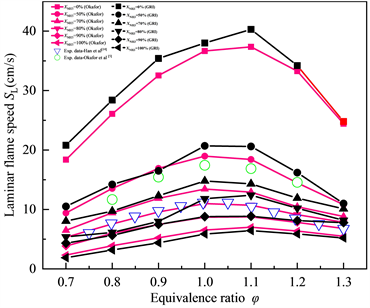
Figure 2. Laminar flame speed of NH3/CH4/Air flame at various equivalence ratios T = 300 K, P = 1 atm (Okafor, GRI-Mech 3.0)
图2. 常温常压NH3/CH4/Air的层流火焰速度SL随当量比φ的变化
3.1.2. 燃料配比对层流燃烧速度的影响
图3展示了φ = 1.0的化学计量条件下NH3/CH4/Air的层流火焰速度SL随不同XNH3的变化趋势,点线图代表通过Okafor机理、GRI-Mech 3.0机理计算得到的结果,空心的散点代表公开文献中,相似条件下的实验数据。如图3所示,化学计量条件下时,NH3/CH4/Air的层流火焰速度SL随二元燃料中NH3所占的摩尔分数XNH3呈现线性变化趋势。层流火焰速度SL随二元燃料中NH3比例的减少而单调增加,说明在NH3中添加CH4会有明显的助燃作用,层流火焰速度SL最大值约为38 cm/s。相较于GRI-Mech 3.0机理,大多数工况下Okafor机理模拟下的数值计算结果与层流火焰速度SL的实验数据更为吻合,但Okafor机理下的计算结果会略高估层流火焰速度SL。而GRI-Mech 3.0机理则相反,会低估层流火焰速度SL,这很可能是由于GRI-Mech 3.0机理中缺少大部分含N自由基的反应。综合来看,两种机理都有一定的误差,但相对而言Okafor机理能够更好的捕捉NH3/CH4/Air的层流火焰速度SL随XNH3的变化趋势,表现出与实验数据更好的一致性。

Figure 3. Laminar flame speed of NH3/CH4/Air flame at various XNH3 T = 300 K, P = 1 atm, φ = 1.0 (Okafor, GRI-Mech 3.0)
图3. 常温常压当量比φ = 1.0时,Okafor,GRI-Mech 3.0机理下NH3/CH4/Air的层流火焰速度SL随XNH3的变化
3.2. 不同机理对层流火焰速度的敏感性分析
3.2.1. 不同当量比下的层流燃烧速度敏感性分析
为了进一步探究详细反应机理Okafor和GRI-Mech 3.0中的基本化学反应对层流火焰速度SL的影响,本工作选择Okafor机理和GRI-Mech 3.0机理,在二元燃料53.5% NH3/46.5% CH4配比时,不同当量比φ下进行化学反应对流率的敏感性分析,其中灵敏度阈值设为0.01。结果如图4所示。
从图4的敏感性分析结果可以看出:1) 根据正向敏感性系数的最大值可以得出所有当量比φ的NH3/CH4/Air火焰中对两种详细反应机理Okafor和GRI-Mech 3.0而言最重要的基本反应都是反应39:H + O2 < = > O + OH,对火焰传播都发挥了最积极的促进作用,贫燃条件φ = 0.7工况下R39的敏感性系数在GRI-Mech 3.0机理,Okafor机理中约为0.5;化学计量条件φ = 1.0工况下R39的敏感性系数在GRI-Mech 3.0机理Okafor机理中约为0.55;富燃条件φ = 1.3工况下R39的敏感性系数在GRI-Mech 3.0机理,Okafor机理中约为0.57,即R39随着当量比的增加对于火焰传播的积极促进作用也是在增大的。2) 根据负向敏感性系数的最大值可以得出在NH3/CH4/Air火焰中对两种详细反应机理Okafor和GRI-Mech 3.0而言最重要的基本反应为三体反应R53或R36,贫燃条件φ = 0.7工况下R36的敏感性系数在GRI-Mech 3.0机理,Okafor机理中最大约为−0.1,但R53的敏感性系数在两个机理中表现出较大差异,R53在GRI-Mech 3.0机理中也表现出较大的敏感性系数约为−0.1,反之在Okafor机理中R53的敏感性系数较低约为−0.05;化学计量条件φ = 1.0工况下三体反应R53的敏感性系数在GRI-Mech 3.0机理,Okafor机理中都是最大的约为−0.12,富燃条件φ = 1.3工况下三体反应R53的敏感性系数在GRI-Mech 3.0机理,Okafor机理中仍为最大值约为−0.17,推测R36在不同φ下在不同机理中敏感性系数的大小很有影响到了GRI-Mech 3.0机理数值模拟结果与实验结果的吻合程度。3) GRI-Mech 3.0机理与Okafor机理还存在的一个主要区别在于GRI-Mech 3.0机理增强了反应R273:HNO + H < = > H2 + NO的负向敏感性系数。除此之外,有两个敏感性系数较大的反应R240:NH + NO < = > N2O + H和R248:NH + H2O < = > HNO + H分别存在于GRI-Mech 3.0机理和Okafor机理中,这也可能是造成两种机理的数值模拟结果存在差异的重要原因之一。

Figure 4. Sensitivity coefficient of chemical reactions to flow rate T = 300 K, P = 1 atm, 53.5% NH3/46.5% CH4 (GRI-Mech 3.0, Okafor) (φ = 0.7, 1.0, 1.3)
图4. 常温常压53.5% NH3/46.5% CH4时,GRI-Mech 3.0,Okafor机理下基本反应相对于流率的敏感性系数
3.2.2. 不同燃料配比下的层流燃烧速度敏感性分析
为了进一步了解两种详细反应机理Okafor和GRI-Mech 3.0中的基本化学反应对层流火焰速度SL的影响,本工作选择在化学计量条件φ = 1.0下对不同燃料配比下(XNH3 = 50%、XNH3 = 80%)的二元燃料NH3/CH4进行化学反应对流率的敏感性分析,灵敏度阈值设为0.01。结果如图5所示。
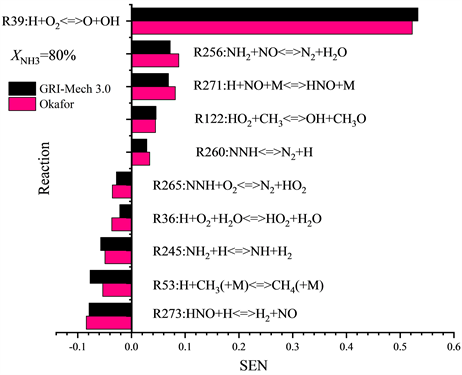
Figure 5. Sensitivity coefficient of chemical reactions to flow rate T = 300 K, P = 1 atm, φ = 1.0 (GRI-Mech 3.0, Okafor) (XNH3 = 50%, 80%)
图5. 常温常压φ = 1.0时,GRI-Mech 3.0,Okafor机理下基本反应相对于流率的敏感性系数
从图5的敏感性分析结果可以看出:1) 根据正向敏感性系数的最大值可以得出所有XNH3下的NH3/CH4/Air火焰中对两种详细反应机理Okafor和GRI-Mech 3.0而言最重要的基本反应仍是反应39:H + O2 < = > O + OH,R39对于火焰传播起到最为积极的作用。化学计量比φ = 1.0条件下在XNH3 = 50%和XNH3 = 80%时R39的敏感性系数在GRI-Mech 3.0机理,Okafor机理中约为0.53,即XNH3的增加对于R39促进火焰传播的积极作用影响不大。2) 在XNH3 = 50%的NH3/CH4/Air火焰中,除了反应256之外的所有增速反应中几乎都与含碳自由基相关,如CH3,CO,以及HCO等;反应53表现出最强的抑制火焰传播的能力。3) 对于XNH3 = 80%的NH3/CH4/Air火焰,所有的增速反应中只有反应122中有含碳自由基的参加,并且敏感性系数也有明显的降低,此时抑制火焰传播最强的反应从反应53转变为反应273。
图4和图5的敏感性分析结果表明,NH3/CH4/Air火焰的层流火焰速度SL很大程度上取决于自由基池内H、O和OH自由基的数量,因此接下来需对不同工况下H、O以及OH自由基的摩尔分数沿轴向的分布趋势进行探究。
3.3. 不同机理对火焰重要自由基的影响分析
3.3.1. 不同当量比下的火焰重要自由基分析
本工作选择Okafor机理和GRI-Mech 3.0机理,在燃料53.5% NH3/46.5% CH4配比条件下,不同当量比φ条件下H、O以及OH自由基的摩尔分数沿轴向的分布,结果如图6所示。
从图6可以看出,Okafor机理和GRI-Mech 3.0机理下NH3/CH4/Air火焰中H、O、OH自由基沿轴向的分布并无显著区别,但区别于O和OH自由基,在贫燃工况φ = 0.7时H自由基含量明显降低。
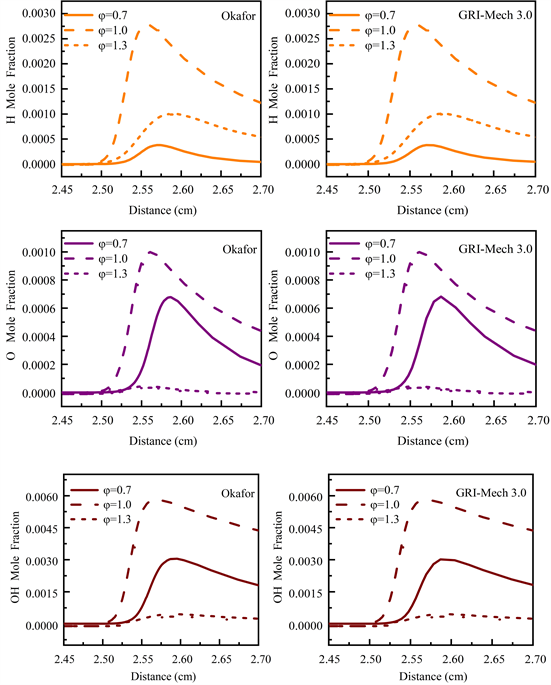
Figure 6. H, O, OH radical mole fraction, T = 300 K, P = 1 atm, 53.5% NH3/46.5% CH4 (GRI-Mech 3.0, Okafor) (φ = 0.7, 1.0, 1.3)
图6. 常温常压53.5% NH3/46.5% CH4,当量比φ = 0.7、1.0、1.3时,Okafor,GRI-Mech 3.0机理下H、O、OH自由基摩尔分数
3.3.2. 不同燃料配比下的火焰重要自由基分析
本工作选择Okafor机理和GRI-Mech 3.0机理,在常温常压当量比φ = 1.0条件下,绘制了不同燃料配比(XNH3 = 50%、XNH3 = 80%)下二元燃料NH3/CH4的H,O及OH自由基摩尔分数沿轴向的分布图,结果如图7所示。
从图7可以看出,Okafor机理和GRI-Mech 3.0机理下NH3/CH4/Air火焰中H、O、OH自由基沿轴向的分布趋势并无显著区别,但相对于GRI-Mech 3.0机理而言,Okafor机理模拟下的H、O及OH自由基摩尔分数更高。同时可以看出随着燃料中NH3占比增加,火焰中H、O及OH三种重要自由基的含量降低。

Figure 7. H, O, OH radical mole fraction, T = 300 K, P = 1 atm, φ = 1.0 (GRI-Mech 3.0, Okafor) (XNH3 = 50%, 80%)
图7. 常温常压当量比φ = 1.0 XNH3 = 50%、80%时,Okafor,GRI-Mech 3.0机理下H、O、OH自由基摩尔分数
4. 机理总结及优化
4.1. 机理对比总结
层流火焰速度SL是描述各种燃烧现象和验证反应机理的重要物理参数,而层流火焰速度SL很大程度上取决于自由基池内H、O和OH自由基的数量,因此本研究重点选择与实验数据吻合较好的Okafor机理和GRI-Mech 3.0机理,以SL为燃烧特性的主要表征参数进行了模拟计算得到了不同NH3/CH4比例的燃料空气混合物的SL,计算了火焰结构以及反应速率曲线分布,并对混合物的流率进行了敏感性分析,并针对敏感性分析的结果,绘制了对SL影响最大的反应速率曲线。从上述模拟结果可以看出在NH3中掺入CH4后显著提高了SL,SL最大值所对应的当量比也会随着燃料组成的不同,在φ = 1.0~1.1之间的富燃料侧内发生着轻微的变化。
根据模拟结果可以看出:
1) 对于NH3/CH4/Air火焰多数工况下Okafor机理模拟下的数值计算结果与层流火焰速度SL的实验数据更为吻合,但Okafor机理数值模拟下的计算结果也会高估层流火焰速度SL,而GRI-Mech 3.0机理模拟下的数值计算结果则相反会低估层流火焰速度SL。
2) 针对敏感性分析结果,GRI-Mech 3.0机理与Okafor机理存在的一个主要区别在于GRI-Mech 3.0机理增强了反应R273:HNO + H < = > H2 + NO的负向敏感性系数。除此之外,有两个敏感性系数较大的反应R240:NH + NO < = > N2O + H只存在于GRI-Mech 3.0机理之中,而反应R248:NH + H2O < = > HNO + H只存在于Okafor机理中。
3) 无论对于哪种机理,在NH3/CH4/Air火焰中最重要的基本反应都是反应39:H + O2 < = > O + OH,反应39属于H2/O2机理的重要基本反应且对火焰传播都发挥了最积极的促进作用。
分析造成这些详细化学反应机理模拟差异的主要原因主要有两方面:一方面是在于反应速率常数的设置,另一方面是在于一些重要中间反应组分和基元反应的缺失。
4.2. 机理优化
分析详细化学反应机理的优化将从以下三个方向开展:1) 通过对上述NH3/CH4/Air火焰模拟结果进行总结分析,Okafor机理在不同当量比和不同燃料配比XNH3的工况下均表现良好,因此将在Okafor机理的基础上进行机理优化。优化的主要方向是调整Okafor机理在NH3比例较高时的NH3/CH4混合燃料层流火焰速度计算中高估的情况。2) 将着重对比分析在NH3/CH4/Air火焰模拟中表现较好的GRI-Mech 3.0机理与Okafor机理存在的差距,找出Okafor机理中缺少而在GRI-Mech 3.0机理中具有较高影响的重要基元反应,将其添加至作为主框架的Okafor机理中。3) 将着重对比分析在NH3/CH4/Air火焰模拟中表现较好的GRI-Mech 3.0机理与Okafor机理存在的差距,找出Okafor机理中敏感性系数较高、重要的基元反应而在GRI-Mech 3.0机理中敏感性系数较低且不作为重要基元反应,对主框架Okafor机理中的该基元反应进行反应速率常数修正,修正的依据则是实验数据。
因此本研究以Okafor机理为作用机理,以层流火焰速度SL为主要参数,以GRI-Mech 3.0机理为主要对标机理,以能够更好地适用于NH3/CH4/Air火焰模拟为主要目的,开展机理优化工作,被优化的机理为Okafor-Modified机理。
4.2.1. 增加重要的基元反应
机理优化工作开展的第一个步骤是增加Okafor机理中没有的重要基元反应,比较GRI-Mech 3.0机理和Okafor机理存在的差异,Okafor机理缺少NH + NO < = > N2O + H这一重要基元反应,而该基元反应在Konnov机理、Glarborg机理、Tian机理以及GRI-Mech 3.0机理中的参数都存在,表1展示了增加重要基元反应的参数来源及相关参考文献。

Table 1. The parameters of the addition reactions and its references
表1. 增加重要基元反应的参数来源及相关参考文献
在Okafor机理中增加表1的基元反应后,得到NH3/CH4/Air的层流火焰速度SL随当量比φ的变化趋势如图8所示,可以看出在Okafor机理中加入对应的基元反应后,优化机理模拟下的层流火焰速度SL相较于Okafor机理而言有所下降,SL随着当量比φ的增加仍呈现出先增大后减小的变化趋势,并且仍在当量比φ约等于1.0附近时SL达到最大值,可以看出优化的机理与实验数据呈现出了更好的吻合性。
按照这种思路,Okafor-Modified共做了15个基元反应的添加。
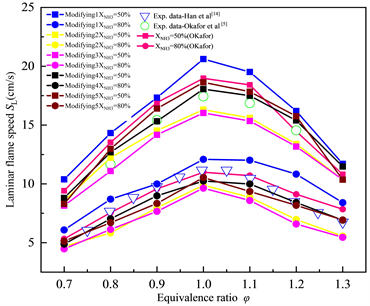
Figure 8. Simulation results after correction of reaction NH + NO < = > N2O + H and H + NO + M < = > HNO + M
图8. H + NO < = > N2O + H和H + NO + M < = > HNO + M反应修正后的模拟结果
4.2.2. 修正更新重要的基元反应
机理优化工作开展的第二个步骤是修正更新原始Okafor机理中重要基元反应的参数,因此分别在T = 300 K,P = 1 atm,53.5% NH3/46.5% CH4配比,当量比φ = 0.7、1.0、1.3条件下,以及T = 300 K,P = 1 atm,当量比1.0,燃料配比XNH3 = 50%、80%、100%这三种情况下的Okafor机理进行化学反应对流率的敏感性分析,模拟结果如图9和图10所示。

Figure 9. Sensitivity coefficient of chemical reactions to flow rate, T = 300 K, P = 1 atm, 53.5% NH3/46.5% CH4, Okafor (φ = 0.7, 1.0, 1.3)
图9. 常温常压53.5% NH3/46.5% CH4时,Okafor机理下基本反应相对于流率的敏感性系数结果
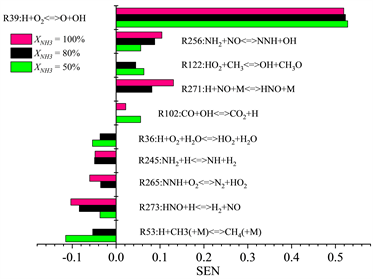
Figure 10. Sensitivity coefficient of chemical reactions to flow rate T = 300 K, P = 1 atm, φ = 1.0 Okafor (XNH3 = 50%, 80%, 100%)
图10. 常温常压φ = 1.0时,Okafor机理下基本反应相对于流率的敏感性系数
根据图9和图10所示敏感性分析结果,以反应R273:HNO + H < = > H2 + NO为例,本研究方法首先分析优化反应R273的可行性。由表2所示,原始的Okafor机理中R273参考指前因子A为9.000E+11,最新参数通过查阅NIST官网化学反应数据库得到,修正为6.600E+10,但是由于反应R273为限速反应,其敏感性系数为负向,所以随着指前因子A减小,反应速率常数k也随着减小,层流燃烧速度抑制效果有所缓解。调整参数后的机理记作Modifying6,重新进行数值计算的结果如图11所示,可以看出层流火焰速度SL相较于Okafor机理而言有所下降,且优化前后造成的下降量呈现先增大后减小的趋势。

Table 2. The parameters of the correct and update reactions with its references
表2. 更新重要基元反应的参数来源及相关参考文献
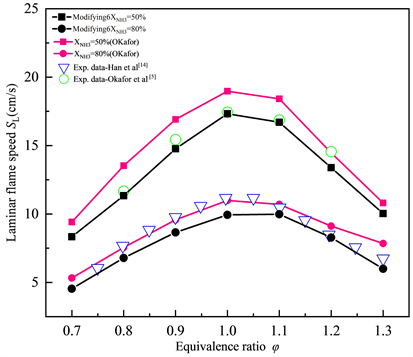
Figure 11. Simulation results after correction of reaction HNO + H < = > H2 + NO
图11. HNO + H < = > H2 + NO反应修正后的模拟结果
4.2.3. 调整基元反应的重要性
机理优化工作开展的第三个步骤是挑选在Konnov、Tian、Glarborg以及GRI-Mech 3.0几种常用机理中敏感性系数较高但在Okafor机理中敏感性系数较低的重要基元反应,并通过校正相关参数加强这些基元反应在Okafor机理中的重要性,以更加满足对层流火焰速度SL的模拟精度。对比发现反应R102是符合要求的反应之一,以反应R102:OH + CO < = > H + CO2为例,修正设置如表3所示。
调整参数后的机理记作Modifying7~10,重新进行数值计算的结果如图12所示,可以看出层流火焰速度SL相较于Okafor机理而言有所下降,且优化前后造成的下降量呈现先增大后减小的趋势。按照以上2和3的两种思路,Okafor-Modified共做了7个基元反应的修正更新。

Table 3. T he parameters of the modified reactions and its references
表3. 优化重要基元反应的参数来源及相关参考文献

Figure 12. Simulation results after correction of reaction OH + CO < = > H + CO2
图12. OH + CO < = > H + CO2反应修正后的模拟结果
4.3. 机理优化结果
最终,经过以上三个步骤,最终优化完成的机理Okafor-Modified共改进了22个基元反应,其中新增基元反应15个,调整参数的基元反应7个,调整细节如表4所示,计算结果如图13和图14所示。
可以看到将优化后的Okafor-Modified机理下对于NH3/CH4/Air的数值模拟结果,与Okafor机理相比,计算结果在富燃工况下得到了改善,优化后机理模拟下的计算结果与实验数据的平均相对误差在10%以内,相对而言表现出了不错的预测能力,详细优化机理模拟前后与实验的平均相对误差如表5所示。
根据表5的平均相对误差数据可知,Okafor-Modified机理对于NH3/CH4/Air的数值模拟结果与实验值相比仍存在偏差。但与Okafor机理相比,平均相对误差在53.5% NH3/46.5% CH4/Air工况下得到有效降低预测能力较好,此外Okafor-Modified相较于Okafor机理,平均相对误差在80% NH3/20% CH4/Air的工况下误差增大,但仍保持在10%以内。总体来看,Okafor-Modified机理对于NH3/CH4/Air模拟的准确度是有所提高的。

Table 4. The parameters of the modified reactions and its references

Table 4. The parameters of the modified reactions and its references
表4. 优化机理基元反应的参数来源及相关参考文献#

Figure 13. Laminar flame speed of NH3/CH4/Air flame at various equivalence ratios after optimization (T = 300 K, P = 1 atm)
图13. 优化后NH3/CH4/Air的层流火焰速度SL随φ变化
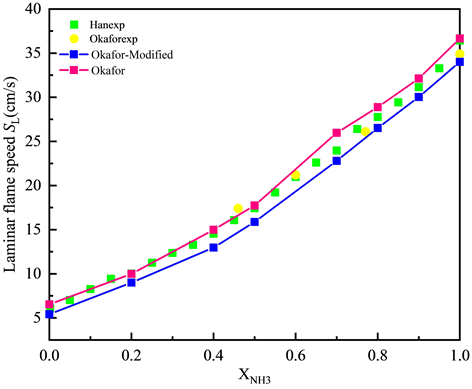
Figure 14. Laminar flame speed of NH3/CH4/Air flame vary with XNH3 after optimization
图14. 优化后NH3/CH4/Air的层流火焰速度SL随XNH3变化

Table 5. Relative error after optimization
表5. 优化前后机理计算的相对误差平均数
5. 结论
能源和环境作为国家社会和经济发展的重要条件,加之在“双碳”目标引领下,推动能源清洁低碳转型既是大势所趋,也是必由之路。NH3作为兼具高氢密度和高能量密度的无碳能源,对于增加其层流火焰速度和减少其主要的燃烧污染产物NOx的研究也是研究者们的热点工作。本文在常温常压下比较探讨了不同机理和不同燃料配比下对NH3/CH4/Air燃烧特性的影响,同时在Okafor机理的基础上结合常见的几种详细反应机理做了详细反应机理优化并优化了机理,主要结论如下:
1) 对于NH3/CH4/Air火焰,随着φ增加,贫燃工况下的层流火焰速度SL随之增大,而在富燃料工况下的层流火焰速度SL随之减小,层流火焰速度SL的峰值位于当量比φ约等于1.1的富燃料侧附近。同时发现燃料CH4的添加有效使NH3的层流火焰速度SL呈现出线性增加趋势,燃烧强度显著提升。
2) 层流火焰速度SL在很大程度上受火焰中自由基O、H、OH数量以及基元反应R39:H + O2 < = > O + OH反应速率的影响,随着燃料中CH4比例的增加,NH3/CH4/Air火焰中的O、H、OH的摩尔分数也随之增大,反应速率也越快,从而进一步提高了NH3的层流火焰速度SL。此外通过敏感性分析以及火焰结构分析火焰中自由基NNH、HNO、NH2既参加自由基H的生成又参与其消耗,然而随着CH4的加入,自由基HCO和CO主要起到促进火焰传播的作用,而自由基HNO,NH2起到抑制火焰传播作用,自由基CH3同时参与火焰传播的促进和抑制。
3) 通过以层流火焰速度SL为燃烧特性的主要表征参数进行了模拟计算得到了不同NH3/CH4比例的燃料空气混合物的层流火焰速度SL,计算了火焰结构以及反应速率曲线分布,并对混合物的流率进行了敏感性分析,并且针对敏感性分析的结果,绘制了对层流火焰速度影响最大的反应速率曲线。结果显示对于NH3/CH4/Air火焰,多数工况下Okafor机理模拟结果与实验数据更为吻合,但在某些工况下高估了层流火焰速度SL。而GRI-Mech 3.0机理相反会低估层流火焰速度SL,同时发现GRI-Mech 3.0与Okafor存在的一个主要区别在于R273:HNO + H < = > H2 + NO的负向敏感性系数差别较大,此外有两个敏感性系数较大的反应R240:NH + NO < = > N2O + H只存在于GRI-Mech 3.0机理之中,而反应R248:NH + H2O < = > HNO + H只存在于Okafor机理中。
4) 基于Okafor机理对NH3/CH4/Air火焰进行了机理优化,优化完成的机理Okafor-Modified增加了15个基元反应,调整7个基元反应的参数,共改进了22个基元反应。Okafor-Modified机理对53.5% NH3/46.5% CH4/Air的数值模拟精准度得到了有效提升,但对于80% NH3/20% CH4/Air的工况数值模拟的相对误差则有所增大但仍在10%的误差范围内。
基金项目
北京市自然科学基金资助(3234059)。
参考文献
NOTES
*注释:基元反应NO.1是参照Konnov机理内的数据进行更新修正的,详细内容见 [5] 。基元反应NO.2是根据Nguyen等人的数值计算拟合结果修正得出的,详细内容见 [11] 。基元反应NO.3,NO.4,NO.7,NO.12是参照Glarborg机理进行更新修正的,详细内容见 [8] 。基元反应NO.5,NO.6是参照Tian机理内的数据进行更新修正的,详细内容见 [9] 。基元反应NO.8~NO.10是参照GRI-Mech 3.0机理的数据进行更新修正的,详细内容见 [10] 。基元反应NO.11是根据Bahng M K等人测定的自由基反应速率常数据进行更新的,详细内容见 [12] 。基元反应NO.13~NO.15是根据Tsang W等人建立的燃烧反应动力学数据库进行更新的,详细内容见 [13] 。基元反应NO.16是根据Sander S P等人补充的化学反应动力学数据进行更新的,详细内容见 [14] 。基元反应NO.17是根据Mebel A M等人重新测定计算的自由基反应速率常数据进行更新的,详细内容见 [15] 。基元反应NO.18是根据Hahn J等人测定的自由基反应速率常数据进行更新的,详细内容见 [16] 。基元反应NO.19~NO.20是根据E Becker,M等人探究基元反应耦合下温度和压力依赖性的实验数据进行更新的,详细内容见 [17] 。基元反应NO.21~NO.22是根据Baulch D L等人补充的反应动力学数据进行更新的,详细内容见 [18] 。