1. 引言
化石燃料的广泛使用所引起的大量二氧化碳排放造成了非常严重的温室效应。随着这些问题变得明显令人不安,寻找替代燃料已经成为全球关注的焦点。为了减少工业活动对环境的影响,科学家们提出了一些可持续和可再生的燃料 [1] [2]。尽管氢被认为是一种很有前途的燃料,但在找到一种安全实用的储存方法之前,实现全球氢经济是不可能的 [3] [4]。
无碳氨(NH3)具有比液氢更高的氢密度,是一种很有前途的绿色能源载体/储存介质。事实上,在温度为20℃,压力为8.6 bar的条件下,1立方米液氨中可以储存108 kg的氢气。在涉及金属氢化物的最先进方法中,NH3的氢密度比其他方法高4倍 [5]。目前,NH3是具有战略意义的化学物质,被广泛用作肥料或大多数其他合成肥料的原料,具有广阔的商业可行性。尽管氨具有毒性,但与氢和汽油相比,它的着火危险性要低得多。NH3的高着火温度使其在运输和分销方面相对安全 [6]。此外,可以使用Haber-Bosch工艺,以甲烷为原料 [7] [8] 并通过煤的气化合成NH3,从商业设施中很容易生产NH3。将来,NH3可能由阳光、水和空气合成 [9]。
过去,NH3用作内燃机、火箭发动机和燃料电池的燃料用途有限 [10]。由于其较低的火焰速度,因此不能在内燃机中直接使用NH3作为燃料。作为另一种无碳燃料,NH3的可燃极限很窄(空气中的体积含量为15.5%至27%)且燃烧速度较低 [9],但是可以通过添加燃烧速度较高的物质(如CH4和H2)来提高。使NH3成为常规内燃机实用燃料的一种方法是将其部分分解。NH3分解产生的氢气对于燃料可燃性的提高具有很强的促进作用 [11]。NH3-H2-空气混合物的反应只包括水(H2O)蒸汽和氮气(N2) (以及少量的NO和N2O)作为最终产物。
作为可用于各种发电系统的清洁燃料,在最近十年中,许多研究致力于预测NH3的燃烧过程。过去,NH3-空气火焰和部分裂解的NH3-空气火焰的结构也经过了多次研究 [12] [13] [14]。与纯H2燃烧相同,NH3和H2混合物的燃烧不会产生CO2。Aaron等人 [14] 采用NH3和柴油双燃料方法,研究了压燃式发动机的燃烧和排放特性。由于较低的燃烧温度导致较低的热氮氧化物,如果NH3在总燃料能量中所占比例低于40%,氮氧化物排放量可能会减少。如果NH3占燃料能量的大部分,氮氧化物会显著增加燃料结合氮的量。HadiNozari等 [15] 数值研究了NH3-H2-空气混合物在高压和稀薄条件下的燃烧特性。结果表明,自由基对燃烧特性有很强的影响。NOx形成的复杂化学高度依赖于控制燃料NOx和热NOx含量的燃料混合物组成。在富燃料条件下操作,掺NH3火焰的总NOx生成量会明显减少。Lee [16] 等人通过实验和数值方法研究了火花点火球形层流预混NH3/H2/空气火焰的表面不稳定性的传播,发展以及氮氧化物(NOx)的排放。NH3替代可大幅降低火焰燃烧速度,在所有情况下,NH3的加入都会增加NOx和N2O的形成。这些结果证明了NH3作为无碳清洁添加剂的潜力,可以改善H2/空气火焰中的安全性能。Li等人 [17] 实验研究了不同空燃当量比和燃气中初始H2浓度下H2和NH3燃烧时的燃烧特性和NOx生成情况。与纯H2-空气燃烧相比,H2-NH3-空气燃烧降低了热NOx,NOx浓度在化学计量燃烧时达到最大值。
由于化学过程中缺乏碳,因此NOx是NH3燃烧的唯一污染物。因此,过去大多数研究的主要目标之一是使NH3燃烧中氮氧化物的浓度最小化。NH3-H2混合燃烧后的NOx包括热NOx和燃料NOx,这与在H2-空气和H2-烃空气中的燃烧完全不同 [17],通常,氨燃烧中的氮氧化物形成主要是燃料结合的氮,而不是大气氮产生的热NOx [18]。因此,需要对NOx形成途径的详细分析,以准确预测由于燃料结合的氮导致的排放。有关NH3-H2-空气的火焰传播速度和NOx生成的报道很少,NH3和H2作为有前途的工业燃料在NH3-H2-空气燃烧中的燃烧速度和NOx生成有待研究。
本研究通过数值计算的方法,计算了不同NH3-H2-空气的层流火焰传播速度以及NOx的排放浓度,通过计算详细的NH3-H2-空气层流火焰的火焰结构、详细化学反应的敏感性分析,相关重要反应的反应速率以及不同掺H2比例下NO的生成和消耗路径,研究了氢气的加入对于提升NH3-空气火焰传播速度和NOx排放背后的原因。
2. 方法
本研究采用Chemkin Pro [19] 软件包中的一维层流火焰速度模型,火焰速度计算模型考虑了自由传播的火焰,用于确定在指定压力和入口温度下混合气体的特征火焰速度。在这种情况下,不考虑热损失,因此温度应该根据能量方程计算。火焰传播速度在一定程度上取决于热量的传递,而预测温度分布是火焰速度计算的一个组成部分。此模型可以计算预混火焰传播速度,火焰的详细结构以及对特定燃烧特性进行敏感性分析。
在预混火焰模型中,用隐式有限差分法求解了反映火焰动力学的控制方程。Chemkin中的火焰速度计算涉及假定一维流动的自由传播火焰。这种结构用于评估在规定的进口压力和温度下,给定的混合气体的火焰速度。对于稳态条件,控制守恒方程的定义如下 [20]:
连续性方程:
(1)
能量方程:
(2)
组分守恒方程:
(3)
状态方程:
(4)
式中x——空间坐标
——质量流率
T——温度
——第k种组分的质量分数
P——压力
u——流体速度
ρ——质量密度
——第k种组分的分子量
——混合物的平均分子量
R——通用气体常数
λ——混合物的热导率
——混合物的定压热容
——第k种组分的恒压热容
——每单位体积中第k种组分通过化学反应产生的摩尔生成速率
——第k种组分的比焓
——气体辐射引起的热损失
A——包围火焰流管的横截面积
自由传播的绝热火焰模型采用混合平均传输选项计算组分的扩散系数,与多组分传输计算方法相比,虽然这种方法的在计算精度虽然有所降低,但是很大程度上减少了计算所需的时间并且更容易收敛 [19]。自适应网格梯度和网格曲率均设置为0.1。
计算采用了详细反应机理GRI-Mech 3.0 [21],GRI-Mech 3.0是一种用于模拟天然气和氢气燃烧的优化机理,包括NO生成和再燃化学反应,该模型已根据氢气,甲烷等碳氢化合物及其混合物层流火焰的氧化,着火,火焰传播速度,火焰结构的实验数据进行了广泛验证。
灵敏度分析方法用于研究数学模型输出的变化如何依赖于模型输入参数的变化。局部归一化灵敏度系数写为 [22]:
(5)
归一化灵敏度矩阵表示为由参数kj的变化引起的浓度cj的变化。
燃料组分由NH3和H2组成,H2的含量通过氢气所占燃料的质量分数
表示为:
(6)
式中:
——燃料中H2的质量分数
,
——分别表示燃料中H2和NH3的质量
氧化剂为空气,初始温度和初始压力设置为常温常压(300 K,1 atm)。
3. 结果和讨论
不要使用空格、制表符设置段落缩进,不要通过连续的回车符(换行符)调整段间距。
图1展示了不同含H2比例的NH3-H2混合物的层流火焰传播速度随当量比的变化趋势,可以发现NH3-H2的火焰传播速度与一般燃料具有相似性,即在化学当量条件附近火焰传播速度高于富燃料和贫燃料区域,火焰传播速度的峰值出现在相比化学当量条件更富的区域,约为φ = 1.1的位置,这与Duynslaegher等人 [23] 所得的结论相类似,这可能是由于过量的燃料产生了一部分热量提升了火焰传播速度。从图1我们还可以看出,纯氨气的火焰传播速度非常低,约为7 cm/s,然而H2的加入很大程度的提升了火焰传播速度,当燃料中所含氢气的质量分数达到12.5%时,火焰传播速度几乎可以达到甲烷燃烧时的水平。此外可以发现,在化学当量条件附近,火焰速度增加的梯度比贫燃料和富燃料区域更大,并且燃料在富燃料区域的火焰传播速度略高于贫燃料区域。
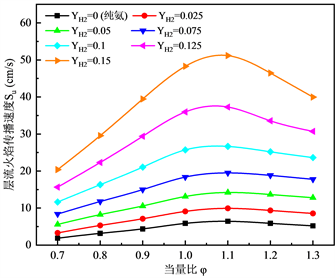
Figure 1. Variation of Laminar flame Propagation speed with equivalence ratio φ
图1. 层流火焰传播速度随当量比φ的变化
图2展示了不同含氢比例的NH3-H2混合物的燃烧后NO摩尔分数随当量比的变化趋势,可以发现,在贫燃料区域,NO的摩尔分数远高于富燃料区域,峰值出现在φ = 0.8的位置。然而随着化学当量比进一步增加,NO的排放逐渐降低,尤其当φ > 1之后,过量的NH3与NO反应,起到了脱硝的作用,NH3在非催化还原(SCR)技术中是一种重要的脱销剂 [20]。此外,燃料中H2的增加会增加出口处NO的摩尔分数,而此时燃料中初始NH3浓度是下降的,这表明H2的增加引起燃烧强度的增强,增加了火焰中快速型和温度型NO的增加。此外可以发现,随当量比进一步增加到1.2时,NO的摩尔分数基本不会随H2的增加而增加。
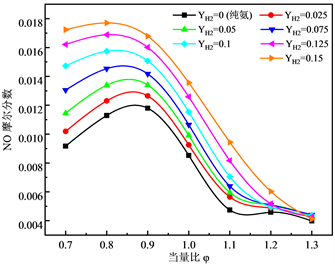
Figure 2. Variation of mole fraction of NO at exit with equivalent ratio φ
图2. 出口处NO摩尔分数随当量比φ的变化
如图3所示,使用详细反应机理GRI-Mech 3.0对不同H2含量的火焰进行了火焰传播速度的敏感性分析,确定了火焰中的限速反应,从而计算出相对于未拉伸层流燃烧速度的一阶归一化灵敏度。主要元素反应的敏感性系数为正数,则表明该反应促进了层流燃烧速度。当主要元素反应的灵敏度系数为负时,表明该反应抑制了层流的层流火焰速度。很明显可以发现,与火焰传播速度相关的自由基主要为H,O,OH自由基,并且与这些自由基相关的反应,如R38,R212,R185对于火焰的传播有促进作用,其中R38的促进作用最强,其次是R212;抑制作用最强的反应为R35以及R214。
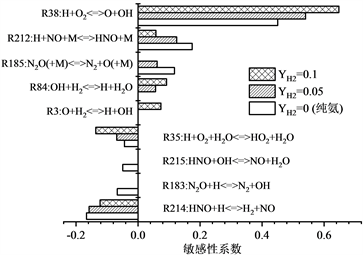
Figure 3. The first-order normalized sensitivity coefficient of laminar flame propagation speed of NH3-H2-air flame, φ = 1
图3. 出NH3-H2-空气火焰的层流火焰传播速度的一阶归一化敏感性系数,φ = 1
图4展示了φ = 1时,在火焰中NO浓度最大点处,NO浓度对基元反应速率常数的一阶归一化敏感性系数,图中显示了火焰中最重要的元素反应。其中敏感性系数为正表示该反应会促进NO的生成,敏感性系数为负表面该反应会抑制NO的生成。从图4我们可以看出,除了H,O,OH自由基以外,含氮自由基同样对NO的生成和消耗起着重要的作用,比如NH,NH2,以及HNO自由基等,当纯氨燃烧时,对NO生成作用最强的反应是R197,其次是R201,这两个反应表明HNO是生成NO的重要前体,此外可以发现R38在促进NO生成反面同样起着非常重要的作用。抑制NO的反应为R202和R199,这表明NH自由基能与NO反应,起到了脱硝的作用。

Figure 4. The first-order normalized sensitivity coefficient of NO mole fraction of NH3-H2-air flame to the elementary reaction, φ = 1
图4. NH3-H2-空气火焰NO摩尔分数对基元反应的一阶归一化敏感性系数,φ = 1
图5展示了NH3-H2-空气的化学当量条件下火焰结构,其中燃料中H2的质量分数为0~0.1,当量比。通过比较图5(a)~(c)可以发现,随着燃料中H2含量的增加,由于燃烧强度的增强,火焰的反应区域变窄,引起火焰中自由基变化梯度有明显的增加。此外H,O,OH自由基在数量上有明显的增加,促进了火焰的传播。含氮自由基除NH自由基以外,NH2和HNO自由基在数量上没有明显的变化趋势,而NH自由基的增加,与更多的NO反应,抑制了NO的生成。
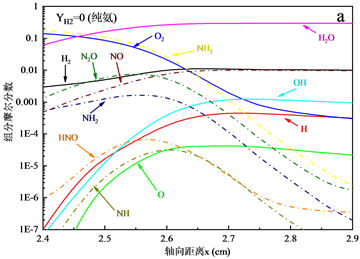
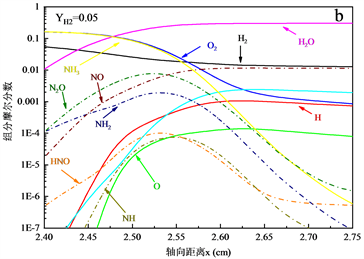
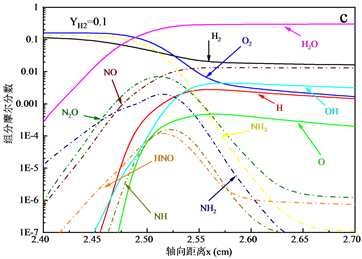
Figure 5. Flame structure of NH3-H2-air flame, φ = 1
图5. NH3-H2-空气火焰的火焰结构,φ = 1
图6展示了NH3-H2-空气火焰中,对火焰传播和NO生成较为重要反应的净反应速率,如图6(a)所示,H2对于反应的净反应速率有较为明显的促进作用,随着燃料中H2的增加,促进火焰传播的相关反应,如R38,R84以及R85的净反应速率都有明显的增加,因此促进了火焰的传播;另一方面,抑制火焰传播的反应,如R212和R214,净反应速率虽然也会随着含H2量的增大而有所增加,但增加的幅度与R38这些促进火焰传播的反应相比较小,因此造成火焰传播速度最终是随含H2量的增加而增加。
图6(b)展示了火焰中与NO生成与消耗相关反应的净反应速率,与图6(a)相类似,所有反应的净反应速率都随着H2的增加而增加,尽管抑制NO的反应如R199和R202的净反应速率非常高,然而从图3可以知道,NO浓度随着H2含量的增加是增加的,这种情况出现的原因可能是火焰中NH自由基含量相对来说较低,如图5所示,其次是一部分NH自由基参与了如R197相关的生成HNO的反应,与NH自由基产生了竞争关系;另外从图4可以看出,反应R38也对NO的生成有促进作用,生成的O自由基与NH2自由基进一步反应,生成了HNO,进一步促进了NO的生成。

Figure 6. Net reaction rate of important reaction in premixed NH3-H2-air flame, φ = 1
图6. 预混NH3-H2-空气火焰重要反应的净反应速率,φ = 1
图7显示了NH3-H2-空气化学当量火焰中,NO的生成及消耗路径,其中H2的质量分数为0~0.1。可以看出,HNO自由基是火焰中NO的重要前体,而NO主要与NH反应,大部分NO被还原成N2O,其次是N2和NNH,此外还有少部分NO被HO2氧化成NO2,同时NO2又被H自由基还原成NO。
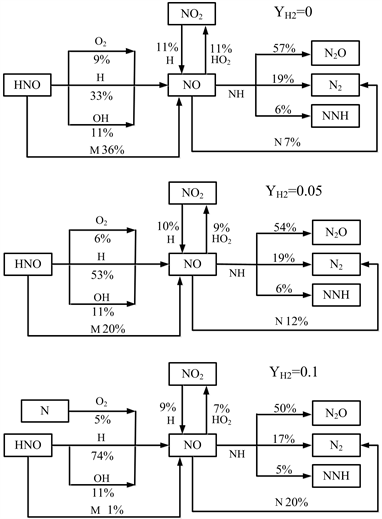
Figure 7. Reaction path of NO in NH3-H2-air flame, φ = 1
图7. NH3-H2-空气火焰NO的反应路径,φ = 1
随着燃料中H2含量增加,HNO->NO的路径发生了变化,H2引起火焰中H自由基数量的增加,HNO更倾向于与H反应生成NO,而HNO与OH的反应没有发现明显的变化,当YH2增加到0.1以后,N自由基优先于与O2反应,参与NO的生成,之后再与NO反应生成N2;此外在H2的作用下,NO几乎不在通过HNO + M的路径生成。对于NO的消耗路径,除NO向N2O的反应有所变化外,NH对NO的还原路径没有较大的变化,而N原子对NO的还原随着H2含量的增加而增加。
4. 结论
本文通过数值计算的方法,计算了NH3-H2-空气的火焰传播速度以及NO摩尔分数,通过火焰结构,反应速率,敏感性分析以及NO的反应路径的方法,研究了H2的加入对于提升氨气空气火焰传播速度和NO排放背后的原因。本文得出的结论如下:
1) 纯氨气的火焰传播速度非常低,约为7 cm/s,然而H2的加入很大程度上提升了火焰传播速度,在化学当量条件附近,火焰速度增加的梯度比贫燃料和富燃料区域更大,并且燃料在富燃料区域的火焰传播速度略高于贫燃料区域。
2) 燃料中H2的增加会引起燃烧强度的增强,增加了火焰中快速型和温度型NO的增加。此外可以发现,随当量比进一步增加到1.2时,NO的摩尔分数基本不会随H2的增加而增加。
3) 与火焰传播速度相关的自由基主要为H,O,OH自由基,并且与这些自由基相关的反应,如R38,R212,R185对于火焰的传播有促进作用,其中R38的促进作用最强,其次是R212;抑制作用最强的反应为R35以及R214。除了H,O,OH自由基以外,含氮自由基同样对NO的生成和消耗起着重要的作用,其中火焰中NH自由基是消耗NO最重要的自由基。
4) H2对于反应的净反应速率有较为明显的促进作用,随着燃料中H2的增加,促进火焰传播的相关反应,如R38,R84以及R85的净反应速率都有明显的增加,因此促进了火焰的传播;另一方面,抑制火焰传播的反应,如R212和R214的净反应速率随H2含量增加的幅度与R38这些促进火焰传播的反应相比较小,因此造成火焰传播速度最终是随含H2量的增加而增加。NO浓度随着H2含量的增加而增加的原因可能是火焰中NH自由基含量相对来说较低,其次是一部分NH自由基参与了如R197相关的生成HNO的反应,此外生成的O自由基与NH2自由基进一步反应,生成了HNO,进一步促进了NO的生成。
5) 随着燃料中H2含量增加,H自由基数量的增加,HNO更倾向于与H反应生成NO,当
增加到0.1以后,N自由基优先于与O2反应,参与NO的生成,此外在H2的作用下,NO几乎不在通过HNO + M的路径生成。对于NO的消耗路径,除NO向N2O的反应有所变化外,NH对NO的还原路径没有较大的变化,而N原子对NO的还原随着H2含量的增加而增加。
NOTES
*通讯作者。