1. 引言
遗传毒性物质甲磺酸甲酯(methyl methanesulfate, MMS)是经典的DNA烷化剂,能诱导碱基中的嘌呤甲基化,从而导致碱基的错配和DNA复制障碍,最终造成基因突或染色体畸变 [1] [2] 。MMS作为典型的DNA损伤剂,是生物医学实验室广泛应用的直接遗传毒物,曾一度在酵母研究被用为拟放射性物质及姐妹染色单体交换诱导剂 [3] ,还被作为聚合、烷化和酯化反应的催化剂和化疗药物而广泛应用 [4] 。MMS的体内水解产物甲磺酸(methanesulfonic acid)亦可作为可逆的昆虫杀虫剂及男性避孕药 [5] 。
目前对MMS的研究主要集中在DNA的损伤修复以及其遗传毒性效应对生殖器官损伤和对肿瘤形成的影响 [3] [6] [7] [8] 。大量的流行病学及实验室研究发现很多遗传毒性物质是诱导心血管疾病发生发展的重要危险因素,如多环芳烃类的苯并芘[benzo(α)pyrene, BαP],化疗药物顺铂(cisplatin)等 [9] - [14] 。同样是遗传毒性物质的MMS是否也同样会引起心血管系统的损伤呢?目前为止相关研究甚少。所以本研究的目的就是从血压,心率,血管舒缩及血小板聚集功能的变化等多方面来探讨MMS对SD大鼠心血管系统造成的影响。
2. 材料与方法
2.1. 材料
2.1.1. 药品与试剂
甲磺酸甲酯(methyl methanesulfonate, MMS)、去氧肾上腺素(phenylephrine, PE)、乙酰胆碱(acetylcholine, ACh)、二磷酸腺苷(ADP)、丙二醛(malondialdehyde, MDA)均购自美国Sigma公司(Saint Louis, MO, USA)。其余试剂均为市售级分析纯购自国药集团化学试剂有限公司(上海,中国)。
2.1.2. 实验动物
清洁级♂ Sprague-Dawley (SD)大鼠购自浙江省实验动物中心,体重200~250 g,合格证号:SCXK(浙)20080033。大鼠在适应性喂养一周后,以生理盐水作空白对照,一次性腹腔注射甲磺酸甲酯(MMS高剂量组60 mg/kg,低剂量组25 mg/kg),分别染毒1天和3天。此外,于染毒前后,分别测定各组大鼠的体重变化。
2.1.3. 实验仪器
ADVIA2120血液分析仪,德国拜耳公司;BP98A大鼠无创血压仪,日本东京软隆公司;离体血管环灌流装置、MedLab v5.0生物信号采集系统,南京美易科技公司;CHORNO-LOG血小板聚集分析仪,美国Chrono-Log公司。
2.2. 方法
2.2.1. SD大鼠胸主动脉张力的测定
各剂量组和对照组的SD大鼠用10%水合氯醛0.4 ml/100g腹腔注射麻醉,放血处死后打开胸腔,迅速游离胸主动脉,置于4℃含95% O2和5% CO2混合气体预饱和的K-H液中[mmol·L−1NaCl 120.0;KCl 4.5;CaCl21.25;KH2PO41.2;MgSO41.2;NaHCO325.0;葡萄糖10.0 (pH 7.4)],小心剔除周围结缔组织,剪成3~4 mm的血管环。将血管环悬挂于预置5 mL K-H液的离体血管环灌流装置中。血管环两端分别连接张力换能器和浴槽底部的不锈钢丝,使用Medlabv5.0生物信号采集系统记录 [15] [16] 。血管环在基础张力为2.0 g的状态下稳定60 min,每15 min换K-H液l次。先后用累积终浓度为10,20,30,40,50,60 mmol·L−1的KCl和累积终浓度为10−9~10−4mol·L−1的PE刺激血管环收缩来检测血管的收缩功能。用10-6M·L-1的PE 收缩血管环达峰值,再加入累积终浓度为10−3~10−8mol·L−1的ACh舒张血管环来检测血管内皮依赖性的血管舒张功能。
2.2.2. 血管超薄切片制备及电镜观察
固定:将上诉剔除干净外周结缔组织的血管环置于2.5%的戊二醛中浸泡固定过夜,用0.1 mol·L磷酸盐缓冲溶液(phosphate buffered solution, PBS)漂洗两次,每次15 min。再用1%锇酸固定液固定1 h。固定完毕,用PBS漂洗两次,每次15 min。脱水:用2%醋酸铀水溶液染色30 min,然后分别用乙醇和丙酮进行梯度脱水:50%乙醇15 min,70%乙醇15 min,90%乙醇15 min,95%乙醇15 min,100%乙醇20 min,100%丙酮脱水20 min (两次)。渗透:向样品中加入丙酮:包埋液(环氧树脂) = 1:1的包埋液,恒温振荡2 h。包埋:将血管环用纯包埋剂,环氧树脂包埋,恒温振荡1.5~2 h,然后置37℃烤箱24 h烘干,在45℃ (24 h),60℃ (48 h)烤箱内聚合硬化。利用超薄切片机切下厚度约为120 nm的切片,将制备的片子干燥后先经4%醋酸铀染色20 min,再用枸橼酸铅染色5 min,在TECNAI 10透射电镜下观察。
2.2.3. 血小板聚集实验
通过下腔静脉取血,每只大鼠约取6 ml,用PH = 6.5的柠檬酸葡萄糖(ACD)抗凝(血液:抗凝剂 = 6:1)。150 g·min−1,常温离心20 min,轻轻吸取上层的澄清富血小板血浆(PRP)。剩余血以800 g·min−1离心20 min分离出贫血小板血浆(PPP),用PPP稀释PRP调节血小板计数为250~300 × 106mL−1。然后,吸取250 ul稀释后的PRP置入聚集管,并放入干净磁珠和5 ul 100 mmol·L−1D的CaCl2于孵育孔道内37℃孵育2 min,置入测试孔道,调零后,加入5ul 100 μmol·L−1的ADP,观察聚集率的变化,观察5 min。
2.2.4. 统计处理
实验结果以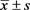 形式表示,两组间比较采用t检验,多组间比较采用ANOVA和Dunnett’s t检验法进行显著性分析(SAS9.1统计软件),检验水准为P < 0.05。
形式表示,两组间比较采用t检验,多组间比较采用ANOVA和Dunnett’s t检验法进行显著性分析(SAS9.1统计软件),检验水准为P < 0.05。
3. 结果
3.1. MMS对SD大鼠体重,血压,心率及外周血细胞的影响
一次性腹腔注射MMS后1天,高剂量组60 mg/kg SD大鼠的体重增量仅为4.4 ± 1.6 g,低剂量组25 mg/kg SD大鼠的体重增量为17.9 ± 2.2 g,相比对照组18.7 ± 1.8 g均有降低,尤其是高剂量组的降低显著,降低了76.5%,P < 0.01(表1)。两处理组大鼠的血压(图1)和心率(数据没显示)跟对照组比没有变化,外周血白细计数胞相比对照组从10.4 ± 0.63 109·L−1降到8.0 ± 0.54 109·L−1(25 mg/ml)和5.2 ± 0.83 109·L−1(60 mg/ml),P < 0.01,其中以淋巴细胞和中性粒细胞计数降低最为明显(表2)。红细胞和血小板计数跟对照比没有变化。一次性腹腔注射MMS后3天,高剂量组体重增值为29.9 ± 1.3 g,相比对照组38.6 ± 1.5 g有显著性差异,向降了22.5%,P < 0.01 (表1),而低剂量组体重增值跟对照比组虽减少,但无统计学差异。两处理组大鼠的血压(图1)和心率(数据没显示)变化跟对照组比仍无差异,而外周血细胞计数变化跟染毒一天后相似(数据没有显示)。

Table 1. The weight gain of SD rats in each group (g)
表1. 各剂量组的SD大鼠体重增加量(g)
,**P < 0.01, compared with control.
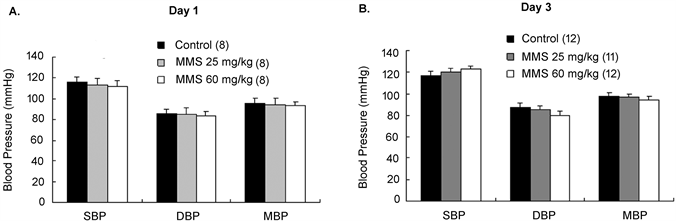
Figure 1. Systolic blood pressure (SBP), diastolic blood pressure (DBP) and mean arterial blood pressure (MBP) of BαP-treated and vehicle-treated rats
图1. 各剂量组SD大鼠的收缩压(SBP),舒张压(DBP),平均压(MBP)变化


Table 2. Analysis of peripheral blood cells in SD rats 1 day after treated with MMS (109·L−1)
表2. SD大鼠染毒1天后外周血细胞计数(109·L−1)
,*P < 0.05,**P < 0.01, compared with control.
3.2. MMS对SD大鼠胸主动脉舒缩及其超微结构的影响
KCl和PE是经典的诱导血管收缩的刺激剂。MMS染毒后第1天,累积浓度为10~60 mmol·L-1的KCl在对照组中诱导血管收缩幅度为0.11 ± 0.06~0.96 ± 0.08 g;KCl诱导低剂量组(25 mg/kg)SD大鼠胸主动脉收缩的幅度为 0.12 ± 0.02~0.98 ± 0.10 g,高剂量组(60 mg/kg)为0.25 ± 0.09~0.94 ± 0.10 g (图2(A)~(C))。两处理组跟对照组相比,血管张力无变化。累计浓度为10−9~10−4mol·L−1的PE在对照组中诱导血管收缩的幅度为0.05 ± 0.01~0.44 ± 0.10 g;PE诱导低剂量组SD大鼠胸主动脉收缩的幅度为0.05 ± 0.01~0.38 ± 0.06 g,高剂量组为0.05 ± 0.01~0.39 ± 0.07 g (图2(A)~(C)),跟对照相比亦无差异。累积浓度为10−3~10−8mol∙L−1的Ach在对照组中诱导经PE预收缩的血管环舒张比为0.11 ± 0.02~1.00 ± 0.03;在低剂量组为0.11 ± 0.02~0.99 ± 0.06;在高剂量组为0.08 ± 0.01~1.00 ± 0.07,处理组跟对照组比较也均无差异。MMS染毒后第3天的血管张力变化与染毒1天的相似(图2(D)~(F))。电镜观察SD大鼠胸主动脉壁超微结构显示(图3):两处理组中,无论是血管平滑肌细胞的排列方式,单位面积的平滑肌细胞计数(表3)及细胞间的间隙还是线粒体和肌浆网等细胞器跟对照组相比无异常。
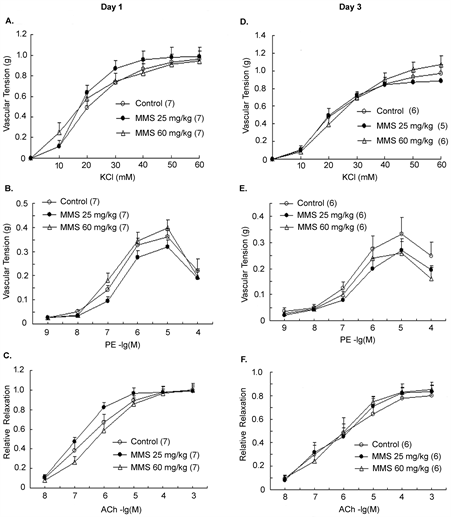
Figure 2. The effect of MMS on thoracic aortic tension of SD rats
图2. MMS对SD大鼠胸主动脉血管张力的影响
Figure 3. The effect of MMS on thoracic aortic ultrastructure of SD rats
图3. MMS对SD大鼠胸主动脉壁超微结构的影响

Table 3. The effect of MMS on smooth muscle cell count (mm−2)
表3. MMS对血管平滑肌细胞计数的影响(mm−2)
3.3. MMS对SD大鼠血小板聚集功能的影响
ADP是经典的刺激血小板聚集的诱导剂之一。ADP刺激对照组血小板聚集的聚集率是53.0% ± 5.4%,低剂量组血小板的聚集率是56.3% ± 4.2%,高剂量组血小板的聚集率是51.9% ± 4.3%,三组比较均无统计学差异,P > 0.05 (图4)。MMS染毒1天,对血小板聚集功能不会产生影响。
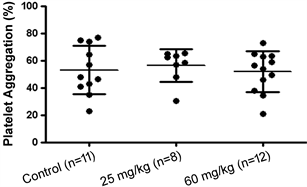
Figure 4. The effect of MMS on ADP induced platelet aggregation of SD rats
图4. MMS对SD大鼠ADP诱导的血小板聚集的影响
4. 讨论
由表1可知,MMS染毒后1至3天,SD大鼠的体重显著下降,其中染毒后第3天的体重增长量相比第1天有所回升,说明MMS在体内代谢较快,SD大鼠能在较快时间代偿MMS对机体造成的损伤。Cumming, R. B.等在小鼠实验中发现,MMS腹腔注射后很快被消化道吸收,并快速分布于肝、肾、肺、脾、心脏、附睾、大脑、睾丸、心脏及平滑肌,24小时后这些脏器中MMS的浓度显著下降 [17] ,这进一步支持了本实验研究结果。另外,MMS严重降低了外周血白细胞的数量(表2),这可能是MMS对外周血炎症细胞的细胞毒性所致 [18] ,因为有大量文献报道MMS能诱导外周血淋巴细胞遗传物质的改变从而导致细胞凋亡 [19] [20] 。然而,MMS并没有改变SD大鼠的血压(图1),这表明MMS的急性毒性对血管壁张力及血流动力学可能无影响。
由图2可知,MMS对KCI和PE诱导的血管收缩及ACh诱导的内皮依赖血管舒张无影响,这提示MMS在体内的急性毒性并不会干扰血管平滑肌正常的舒缩功能。同时图3的电镜图片显示,MMS无论对血管壁的超微结构还是对平滑肌细胞的数量都没有损伤,这进一步说明MMS的急性毒性可能不会对平滑肌的舒缩功能产生影响。此结果也进一步支持了MMS可能不会导致血压的变化,与图1的结果相吻合。
鉴于心血管系统是个复杂而完整的系统,本研究除了检测MMS对血管舒缩,血压,心率及外周血细胞的检测之外,还观察了MMS对血栓形成的影响。因为在血栓形成过程中,血小板激活聚集起了至关重要的作用 [21] ,所以本实验采用ADP诱导血小板聚集的方法来观察MMS是否会对血小板聚集功能产生影响,从而初步探讨MMS在机体血栓形成中的作用。由图4可知,MMS处理后的大鼠血小板聚集率与对照组相比并无明显差异,提示急性染毒MMS不会对ADP诱导的血小板聚集产生影响,进一步可以推断MMS 可能不会促进SD大鼠血栓的形成。其可能原因为MMS作为经典的DNA损伤剂,主要以DNA为作用靶点,而血小板缺乏DNA,受到的影响可能较小。
本研究存在一定的不足和局限性。首先,本次试验为探索性研究,观察时间较短,无法评价MMS对SD大鼠心血管系统中远期的影响。此外,由于未观察到显著的毒作用,对MMS影响SD大鼠心血管系统的潜在分子机制未能进行深入研究。因此,在将来的研究中,需要增加观察时间,充分评价MMS对SD大鼠心血管系统的影响及可能的分子机制。
综上所述,虽然MMS是公认的遗传毒性物质,能损伤多器官多细胞的遗传物质,从而导致细胞坏死或凋亡,严重影响该器官的生理结构和功能,但MMS的急性毒性并不会改变大鼠的血压,心率,血管张力及血小板聚集功能,即MMS对心血管系统的正常功能并没有明显影响,这可能跟其在体内的快速代谢相关。
基金项目
国家自然科学基金青年基金(81602795);浙江省自然科学基金(LZ19H260001, LQ15H26002, LY19H260002)。
NOTES
*第一作者。
#通讯作者。