1. 引言
人类膀胱出口部分梗阻(Partial bladder outlet obstruction,P-BOO)常继发于慢性前列腺增生,一般认为膀胱逼尿肌细胞的增生、肥大是该病的病理学基础。这些组织学的改变伴随相应的功能改变,包括残余尿量增多,尿频及排尿压的改变。缝隙连接是通过位于相邻细胞膜之间的连接子构成,其化学成分为六聚体的连接蛋白。目前发现在人体中至少有13种缝隙连接蛋白基因。缝隙连接蛋白介导的细胞间通讯可能在调控胚胎的发育,细胞的生长、分化等方面发挥重要作用。缝隙连接是人体及动物细胞膜上的特殊结构,构成了相邻细胞间的特殊通道,信息离子(包括钙离子)及小分子可通过此通道进入细胞间的转运,调节许多重要的生理功能。在心血管疾病的基础研究中发现缝隙连接介导的细胞间通讯参与了细胞间的兴奋传导 [1] 。缝隙连接介导的细胞间通讯直接参与相邻细胞间神经信号的传收缩方面发挥重要作用 [2] [3] [4] 。
Haefliger, J.A.等通过实验发现缝隙连接蛋白-43(Connexin-43,Cx-43)是大鼠逼尿肌细胞中重要的连蛋白。在人类的逼尿肌细胞中同样发现了Cx-43与Cx-45 [5] [6] 。在一项关于排尿功能障碍的研究中发现Cx-43在逼尿肌中的表达发生改变。Fry等指出逼尿肌的兴奋依赖于缝隙连接的存在 [7] [8] 。
本实验通过探讨P-BOO的大鼠逼尿肌细胞膜上缝隙连接和Cx-43表达的变化,为逼尿肌中缝隙连接的改变可导致尿流动力学改变提出了形态学和免疫组织化学的证据。
2. 材料与方法
2.1. P-BOO动物模型的建立
10周龄雌性Wistar大鼠,体重170~260 g,均由北京维通利华实验动物有限公司提供(动物合格证SCXK (京) 2007-0009、SPF级)。33只大鼠被随机分为6组:模型组中造模后2周处死6只;造模后4周处死6只;造模后8周处死6只。假手术组中2周处死5只;4周处死5只;8周处死5只。上述各组大鼠处死后取膀胱逼尿肌组织进行后期实验。P-BOO动物模型的建立参照Mattiasson 和 Uvelius [9] 和Malmgren等 [10] 的造模方法。大鼠通过腹腔注射25%乌拉坦(1 g/kg)麻醉后,用硬膜外导管(直径1 mm)经尿道插入膀胱,小心游离尿道,游离至近膀胱颈口处,4-0 PGLA医用可吸收丝线结扎近膀胱颈口处尿道,结扎松紧度以线结刚靠近尿道为宜,拔出导管,缝合皮肤。假手术组操作同上,但不结扎尿道。
2.2. 排尿压测定
将实验大鼠,25%乌拉坦(1 g/kg)腹腔注射麻醉 [11] ,仰卧固定,用硬膜外导管(直径1 mm)经尿道插入膀胱,硬膜外导管接经三通管与尿动力仪及微量泵(UDS-600,加拿大)相连。标定零点,生理盐水经微量灌注泵向膀胱灌注,速度为0.2 mL/min [12] ,同步记录随容积增加膀胱压力波形、大小变化,至尿道口周围溢水定义为膀胱最大容量(灌注速度×灌注时间=膀胱最大容量)并记录膀胱残余尿量。
2.3. 免疫组织化学检测
所有膀胱逼尿肌样本均用4%的多聚甲醛浸泡固定,常规石蜡包埋,连续切片。随后加入一抗兔抗大鼠的Cx-43多克隆抗体(1:100武汉博士德生物工程有限公司),过氧化物酶标记的二抗(1:100武汉博士德生物工程有限公司)。对照组中用0.01 mmoL/L PBS (武汉博士德生物工程有限公司)代替一抗作阴性对照。
2.4. 冰冻蚀刻分析
样本加戊二醛固定,随后加入30%的甘油缓冲液,置入液氮中冷冻。样本在−112℃的冷冻断裂机(JFD-7000日本)中被反复破碎断裂。样本在次氯酸钠溶液中被消化,随后加入浓度为1:1的甲基氯仿对丙烯基苯酚和100%二甲基甲酰胺。将复合物置于网格中在透射电子显微镜(JEM-1210日本)下观察。
2.5. 免疫蛋白印记(Western-blotting)检测
膀胱逼尿肌组织被剔除粘膜层后加入1 mmol/L碳酸氢钠溶液和2 mmol/L苯基甲磺酰氟化物蛋白酶抑制剂的混合片剂(Roche美国),同时经高频声波处理。Western-blotting和SDS-PAGE 电泳(每个泳道上样40 μg)。为了检测Cx-43的含量,先后加入兔抗大鼠的Cx-43多克隆抗体和用过氧化物酶标记的荧光二抗。检测结果采用增强化学发光法显色,X光片曝光显影,凝胶图象处理系统(EPA-3000日本)分析目标带的分子量和净光密度值。
2.6. 统计学分析
所有数据均以均数±标准差(
± s)表示,Mann-Whitney U test进行模型组和假手术组的比较。结果差异显著,有统计学意义(P < 0.05)。
3. 结果
3.1. 膀胱重量及容量
对18只模型组大鼠及15只假手术组大鼠进行测定,发现模型组大鼠的膀胱重量较假手术组大鼠显著增加(P < 0.01;表1)。在术后4周和8周模型组大鼠的膀胱容积较术后2周显著增加(P < 0.05)。
3.2. 膀胱测压结果
在假手术组中大鼠的排尿模式正常。在术后2周模型组大鼠的排尿压较假手术组显著增加。然而,模型组中术后4周大鼠的排尿压较术后2周显著降低。在模型组中术后8周大鼠的逼尿肌没有发生收缩,同时出现尿失禁现象(图1)。
3.3. 大鼠逼尿肌细胞膜中Cx-43的免疫组织化学染色结果
对模型组和假手术组大鼠逼尿肌细胞进行Cx-43的免疫组织化学染色观察。Cx-43在术后2周模型组大鼠的逼尿肌细胞胞膜、胞质、胞核中均有表达。另外,术后4周在模型组大鼠逼尿肌细胞的胞质、胞核和胞膜上均有部分表达。然而,在术后8周模型组大鼠逼尿肌细胞中Cx-43主要被检测到在胞质或胞核中,胞膜未见其表达(图2)。在假手术组大鼠的逼尿肌细胞中Cx-43的表达未见异常。模型组中随着术后时间的延长,Cx-43的表达也随之降低:2周100%;4周76.4% ± 2.3%;8周4.3% ± 1.6%。
3.4. 缝隙连接的形态学分析
观察缝隙连接的数量。每个缝隙连接像凝聚的圆形颗粒(图3)。在假手术组大鼠逼尿肌中存在许多缝隙连接,并且每个网格中缝隙连接的数量分别为:术后2周3.2 ± 0.12;术后4周2.1 ± 0.77;术后8周3.0 ± 0.57。然而,在模型组大鼠逼尿肌中缝隙连接的数量在对应时间内较假手术组显著降低,分别为:术后2周1.7 ± 0.42;术后4周1.1 ± 0.55;术后8周没有检测到缝隙连接的存在。缝隙连接的形态在两组

Table 1. Bladder weight and capacity
表1. 膀胱重量及容积
注:*P < 0.01。

Figure 1. Bladder pressure. Examples of voiding patterns of control and P-BOO rats at 2, 4, and 8 weeks from cystometric investigation. PB2W, PB4W, and PB8W indicate P-BOO rats 2, 4, and 8 weeks after surgery, respectively. Intravesical pressure of P-BOO rats at 2 weeks was significantly greater than in control rats and gradually decreased after 2 weeks. No detrusor contraction was observed in P-BOO rats at 8 weeks after surgery, and voiding had characteristics of overflow
图1. 膀胱测压。假手术组大鼠排尿期膀胱内压力正常,模型组中大鼠在术后第2周(PB2W)、第4周(PB4W)、第8周(PB8W)排尿期膀胱内压力均发生变化。其中,术后2周膀胱内压力较假手术组明显增高,且随着时间的推移有逐渐减弱的趋势,在术后第8周出现无逼尿肌收缩并出现尿失禁
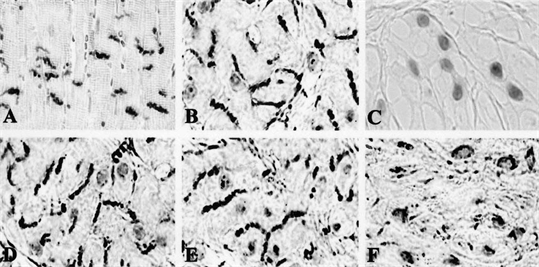
Figure 2. Immunohistochemical staining of Cx-43. (A) Positive control. Cx-43 expressed on cell membranes of mouse heart; (B) Control rats at 8 weeks. Cx-43 expressed on cell membranes of detrusor muscle; (C) Negative control of P-BOO rats; (D) Cx-43 expressed on cell membranes in P-BOO rats at 2 weeks; (E) Cx-43 plaques partly expressed in both cytoplasm and nuclei and on cell membrane in P-BOO rats at 4 weeks; (F) Cx-43 in P-BOO rats at 8 weeks expressed in cytoplasm and nuclei
图2. 缝隙连接蛋白-43免疫组织化学染色(×400)。(A) 阳性对照组选取Cx-43在大鼠心肌细胞膜上的表达;(B) 假手术组术后8周Cx-43在大鼠逼尿肌细胞胞膜上的表达;(C) 阴性对照组;(D) 模型组术后2周Cx-43在大鼠逼尿肌细胞胞膜、胞质和胞核上均有表达;(E) 模型组术后4周Cx-43在大鼠逼尿肌细胞胞膜、胞质和胞核上均有部分表达;(F) 模型组术后8周大鼠逼尿肌细胞中Cx-43在胞质或胞核中有表达,胞膜未见其表达

Figure 3. Freeze-fracture study demonstrating gap junction of detrusor muscle in (A) control rats and (B) P-BOO rats at 4 weeks. White arrows indicate gap junction
图3. 冰冻蚀刻分析逼尿肌中缝隙连接的形态(×25,000) (白色箭头所示缝隙连接;A假手术组、B 模型组)
中没有差异。
3.5. Western-blotting检测与SDS-PAG电泳结果
在假手术组中Cx-43的表达没有显著不同。在模型组中Cx-43的表达较假手术组显著增高。而且,在模型组中Cx-43的表达随时间的延长而逐渐增强(图4)。
4. 讨论
通过缝隙连接介导的细胞与细胞间的信息通讯对排尿功能调节有密切关系。术后2周Cx-43在两组大鼠逼尿肌细胞膜上均有表达,说明逼尿肌的收缩是通过缝隙连接介导的。术后4周模型组大鼠逼尿肌细胞中Cx-43在胞质、胞核及胞膜上均有表达。在术后8周模型组大鼠逼尿肌细胞中Cx-43主要集中表达于胞质或胞核上而不是在胞膜上。上述结果提示细胞膜上Cx-43表达降低导致了缝隙连接介导的细胞间通讯障碍。通过电子显微镜观察发现模型组大鼠逼尿肌中随着梗阻时间的延长缝隙连接数量逐渐减少。因此,Cx-43在细胞膜上表达的降低与逼尿肌的收缩和梗阻时间呈平行关系。
Christ等 [13] 报道在膀胱过度活动症的大鼠逼尿肌中Cx-43mRNA和蛋白表达是显著增加的。在本研

Figure 4. Expression of Cx-43 in P-BOO rats was greater than that in control rats. Expression of Cx-43 protein in P-BOO rats gradually increased from 2 to 8 weeks
图4. 缝隙连接蛋白-43的免疫蛋白印记分析。模型组中Cx-43在大鼠逼尿肌细胞中的表达显著高于假手术组,且随着时间的推移在模型组中Cx-43的表达也明显增高
究中发现Cx-43在模型组中的表达较假手术组显著增强,并且通过制造P-BOO导致Cx-43在逼尿肌中的表达上调。Cx-43的表达上调与Cx-43在胞膜中的表达下降可能是由于P-BOO所致逼尿肌细胞过分拉伸。
国外报道Cx-43参与膀胱壁收缩来增加排尿压。然而,逼尿肌的收缩和Cx-43的定位没有明确 [14] 。Cx-43的表达位置在研究缝隙连接耦连功能上发挥重要作用 [15] [16] [17] 。本实验结果提示在P-BOO的大鼠逼尿肌细胞膜上Cx-43的表达是降低的。因此,相信当Cx-43不能表达在逼尿肌细胞膜上时膀胱逼尿肌细胞是不能发生同步收缩的。
在膀胱逼尿肌中缝隙连接介导的细胞间通讯的功能障碍,究其原因是因为Cx-43在逼尿肌细胞膜上的表达降低所致。因此,正常的电信号不能在逼尿肌细胞中传递,致使排尿功能障碍。所以,缝隙连接的改变可能是导致排尿功能障碍性疾病发生的原因之一。
NOTES
*通讯作者。